在2 L密闭容器中,充入1 mol N2和3mol H2,恒温恒容条件下发生合成氨反应,2 min时达到平衡。测得平衡时N2的转化率为40%,求:
(1)用H2表示2min内该反应的平均反应速率
(2)NH3的平衡浓度
(3)H2在平衡混合气体中的体积分数
(4)平衡时容器的压强P平与起始时压强P始之比
(1)N2(g)+3H2(g)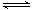 2NH3(g)
2NH3(g)
始 1 mol 3 mol 0 mol
变 0.4 mol 1.2 mol 0.8 mol
平 0.6 mol 1.8 mol 0.8 mol
v(H2)=△C(H2/)△t=0.3 mol/(L·min)
(2)N2(g)+3H2(g)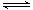 2NH3(g)
2NH3(g)
始 1 mol 3 mol 0 mol
变 0.4 mol 1.2 mol 0.8 mol
平 0.6 mol 1.8 mol 0.8 mol
c(NH3)平=0.4 mol/L
(3)恒温恒容条件下,体积比等于物质的量之比,H2的体积分数= 1.8/(1.8+0.6+0.8 )=56.25%
(4)PV=nRT,恒温恒容时压强比等于物质的量之比,P平:P始=n平:n始=(1.8+0.6+0.8):(1+3)=4:5
