(1)已知:2SO2(g)+O2(g)⇌2SO3 (g)△H=-196.6kJ•mol-1;2NO(g)+O2(g)⇌2NO2(g)△H=-113.0kJ•mol-1 .则反应NO2(g)+SO2(g)⇌SO3(g)+NO(g)的△H=______kJ•mol-1
一定条件下,将NO2与SO2 按体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是______.
a.体系压强保持不
b.混合气体颜色保持不变
c.SO3与NO的体积比保持不变
d.每消耗1mol SO3的同时生成1mol NO2
(2)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)⇌CH3OH(g).CO在不同温度下的平衡转化率与压强的关系如图1所示.该反应△H______0(填“>”或“<”).实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是______
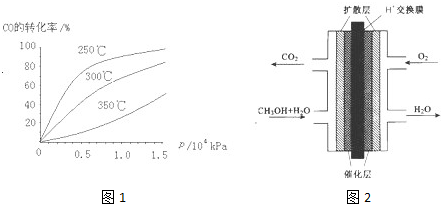
(3)甲醇(CH3OH)燃料电池的结构示意图如图2.甲醇进入______极(填“正”或“负”),正极发生的电极反应为______.
(4)101kPa时,若16gCH3OH完全燃烧生成液态水,放出热量为363.25kJ/mol,则甲醇燃烧的热化学方程式为______.
(1)根据盖斯定律,将第二个方程式颠倒过来,与第一个方程式相加得:2NO2+2SO2═2SO3+2NO,△H=-83.6 kJ•mol-1,则NO2+SO2⇌SO3+NO,△H=-41.8 kJ•mol-1;
a、本反应是反应前后气体分子数不变的反应,故体系的压强保持不变,故a不能说明反应已达到平衡状态;
b、随着反应的进行,NO2的浓度减小,颜色变浅,故b可以说明反应已达平衡;
c、SO3和NO都是生成物,比例保持1:1,故c不能作为平衡状态的判断依据;
d、d中所述的两个速率都是逆反应速率,不能作为平衡状态的判断依据;故选b;
故答案为:-41.8;b;
(2)由图可知,温度升高,CO的转化率降低,平衡向逆反应方向移动,故逆反应是吸热反应,正反应是放热反应,△H<0;压强大,有利于加快反应速率,有利于使平衡正向移动,但压强过大,需要的动力大,对设备的要求也高,故选择250℃、1.3×104kPa左右的条件.因为在250℃、压强为1.3×104 kPa时,CO的转化率已较大,再增大压强,CO的转化率变化不大,没有必要再增大压强,
故答案为:<;在1.3×104kPa下,CO的转化率已较高,再增大压强CO的转化率提高不大,而生产成本增加得不偿失;
(3)甲醇燃料电池中,甲醇中C元素的化合价升高,则甲醇为负极,电解质为酸,甲醇失去电子生成二氧化碳,电极反应为CH3OH+H2O-6e-=CO2+6H+,氧气再正极上得到电子发生还原反应在酸溶液中生成水,反应的电极反应为:O2+4H++4e-═2H2O,
故答案为:负; O2+4H++4e-═2H2O;
(4)101kPa时,若16gCH3OH物质的量为0.5mol,完全燃烧生成液态水,放出热量为363.25kJ/mol,则1mol甲醇燃烧放热726.5KJ;反应的热化学方程式为:CH3OH(l)+3/2 O2(g)═CO2(g)+2H2O(l)△H=-726.5 kJ/mol,
故答案为:CH3OH(l)+3/2 O2(g)═CO2(g)+2H2O(l)△H=-726.5 kJ/mol.
