科学家预测“氢能”将是未来最理想的新能源.请回答下列问题:
(1)实验测得,1克氢气燃烧生成液态水放出142.9kJ热量,则表示氢气燃烧热的热化学方程式为______
A.2H2(g)+O2(g)=2H2O(l);△H=-142.9kJ/mol
B.H2(g)+1/2O2(g)=H2O(l);△H=-285.8kJ/mol
C.2H2(g)+O2(g)=2H2O(l);△H=-571.6kJ/mol
D.H2(g)+1/2O2(g)=H2O(g);△H=-285.8kJ/mol
(2)根据“绿色化学”的思想,为了制备H2,某化学家设计了下列化学反应步骤:
①CaBr2+H2O
CaO+2HBr ②2HBr+Hg 750℃ .
HgBr2+H2↑ 100℃ .
③HgBr2+CaO
HgO+CaBr2 ④2HgO 250℃ .
2Hg+O2↑ 500℃ .
上述过程的总反应可表示为______.
(3)利用核能把水分解,制出氢气,是目前许多国家正在研究的课题.下图是国外正在研究中的一种流程(硫-碘热循环法),其中用了过量的碘.
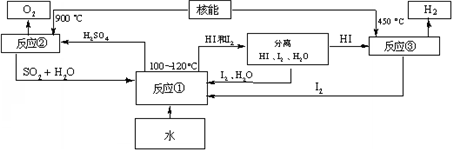
请写出反应①的化学方程式:______.
用硫-碘热循环法制取氢最大的优点是______.
(4)也有人认为利用氢气作为能源不太现实.你的观点呢?请说明能够支持你的观点的两点理由______.
(1)1克氢气燃烧生成液态水放出142.9kJ热量,1moL放出的热量为285.8kJ,燃烧热的热化学方程式中可燃物物质的量为1moL,生成稳定的氧化物,水的状态为液态,故选B.
(2)①CaBr2+H2O
CaO+2HBr ②2HBr+Hg 750℃ .
HgBr2+H2↑ 100℃ .
③HgBr2+CaO
HgO+CaBr2 ④2HgO 250℃ .
2Hg+O2↑ 500℃ .
将(①+②+③)×2+④,得:2H2O

2H2↑+O2↑,
故答案为:2H2O

2H2↑+O2↑;
(3)由图知:反应物为:SO2,I2,H2O,生成物为:HI,H2SO4,故方程式为:SO2+I2+2H2O

2HI+H2SO4,
H2SO4可分解为SO2,O2,H2O,SO2和I2可循环使用,故答案为:SO2+I2+2H2O

2HI+H2SO4 SO2和I2可循环使用,无污染;
(4)现有的制取氢气方法耗能大,制取的成本太高,另外是氢气的熔沸点太低,给储存和运输带来困难.
故答案为:不现实,理由是现有的制取氢气方法耗能大,制取的成本太高,另外是氢气的熔沸点太低,给储存和运输带来困难.(或:现实,制取氢气用水为原料,来源丰富;氢气燃烧的产物是水,不会给环境带来任何污染等.)
