通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能.键能的大小可用于估算化学反应的反应热(△H).
| 化学键 | Cl-Cl | H-H | H-Cl | N≡N |
| 键能/kJ•mol | 243 | 436 | 431 | 946 |
a 2HCl(g)=H2(g)+Cl2(g);△H=______
b N2(g)+3H2(g)=2NH3(g)△H=-92kJ/mol,则N-H键的键能是______kJ•mol
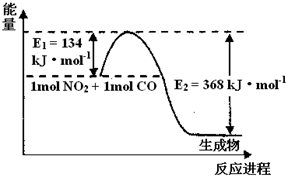
(2)1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式______
______
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1
②2CO (g)+O2(g)=2CO2(g)△H2
③H2O(g)=H2O(l)△H3
则CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=______(用含△H1、△H2、△H3的式子表示)
(4)已知:2Al (s)+
O2(g)═Al2O3(s)△H=-1 644.3kJ•mol-13 2
2Fe (s)+
O2(g)═Fe2O3(s)△H=-815.88kJ•mol-13 2
试写出铝粉与氧化铁粉末发生铝热反应的热化学方程式______.
(1)a 2HCl(g)=H2(g)+Cl2(g);△H=(2×431)kJ•mol-1-(436kJ•mol-1+243 kJ•mol-1)
═+183 kJ/mol
b N2(g)+3H2(g)=2NH3(g)△H=-92kJ/mol,
△H=946 kJ/mol+(3×431)kJ/mol-3×2×N-H键的键能=-92kJ/mol,
所以N-H键的键能=391 kJ/mol
故答案为:+183 kJ/mol; 391
(2)因反应物的物质的量都为1mol,所以其反应物的计量数为1,再根据原子守恒配平方程式;
根据图象知,△H=-(E2-E1)=-(368-134)kJ/mol=-234 kJ•mol-1
故答案为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234 kJ•mol-1
(3)①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1
②2CO (g)+O2(g)=2CO2(g)△H2
③H2O(g)=H2O(l)△H3
则CH3OH(l)+O2(g)=CO(g)+2H2O由
①-1 2
②+2③得到,1 2
所以△H=
△H1-1 2
△H2+2△H31 2
故答案为:
△H1-1 2
△H2+2△H31 2
(4)铝热反应的反应物是铝粉与氧化铁粉末,生成物是铁和氧化铝,
2Al (s)+
O2(g)═Al2O3(s)△H=-1 644.3kJ•mol-1 ①3 2
2Fe (s)+
O2(g)═Fe2O3(s)△H=-815.88kJ•mol-1 ②3 2
方程式①-②得2Al (s)+Fe2O3(s)
Al2O3(s)+2Fe (s) △ .
所以△H=△H(①)-△H(②)=-1 644.3kJ•mol-1-(-815.88kJ•mol-1)
=-828.42 kJ mol-1
故答案为:2Al (s)+Fe2O3(s)═Al2O3(s)+2Fe (s)△H=-828.42 kJ mol-1
