工业上用CO生产燃料甲醇.一定条件下发生反应:
CO(g)+2H2(g)

CH3OH(g).
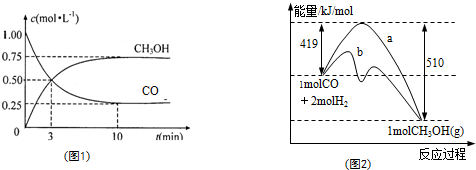
(1)图1是反应时CO和CH3OH(g)的浓度随时间变化情况.从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)=______;
(2)图2表示该反应进行过程中能量的变化.曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化.该反应是______(选填“吸热”或“放热”)反应,写出反应的热化学方程式______;选择适宜的催化剂,______(填“能”或“不能”)改变该反应的反应热;
(3)该反应平衡常数K的表达式为______,温度升高,平衡常数K______(填“增大”、“不变”或“减小”);
(4)恒容条件下,下列措施中能使
增大的有______.n(CH3OH) n(CO)
a.升高温度; b.充入He气 c.再充入1molCO和2molH2 d.使用催化剂.
(1)由图可知,CO浓度变化量为1.00mol/L-0.25mol/L=0.75mol/L,△t=10min,则v(CO)=
=0.075mol/(L•min),0.75mol/L 10min
故答案为:0.075mol/(L•min);
(2)反应物的总能量为419kJ,生成物的总能量为510kJ,则该反应为放热反应,放出的热量为419kJ-510kJ=91kJ,热化学方程式为CO(g)+2H2(g)=CH3OH(g)△H=-91 kJ/mol,
该反应使用催化剂,只能改变反应的途径降低反应所需的活化能,而不能改变反应热,
故答案为:放热;CO(g)+2H2(g)=CH3OH(g)△H=-91 kJ/mol;不能;
(3)由反应CO(g)+2H2(g)

CH3OH(g),则K=
,因该反应为放热反应,则升高温度,化学平衡逆向移动,K值减小,c(CH3OH) c(CO)×c2(H2)
故答案为:
;减小;c(CH3OH) c(CO)×c2(H2)
(4)使
增大,化学平衡应正向移动,但升高温度时化学平衡逆向移动,恒容条件下充入He气化学平衡不移动,使用催化剂化学平衡不移动,在恒容条件下再充入1molCO和2molH2,压强增大,化学平衡正向移动,符合题意,故c正确,故答案为:c.n(CH3OH) n(CO)
