能源是人类生存和发展的重要支柱.研究和有效地开发新能源在能源紧缺的今天具有重要的理论意义.已知H2与CO反应生成CH3OH的过程如图所示:CO的燃烧热△H2=-bkJ•mol-1,CH3OH的燃烧热△H3=-ckJ•mol-1.请根据以上信息,回答下列有关问题:
(1)CH3OH燃烧的热化学反应方程式为______.
(2)H2的燃烧热为______.
(3)一些化学键键能如下:C≡O为d kJ/mol;O=O为ekJ/mol;C=O为fkJ/mol.则由以上数据有b=______(用d、e、f的代数式表示).
(4)H2和CO的混合气体nmol,充分燃烧共放出QkJ热量,则混合气体中H2和CO的物质的量之比为______.
(5)CO与O2可以组成新型燃料电池,若该电池以Pt为电极,以KOH为电解质溶液,写出该燃料电池的负极反应式______.
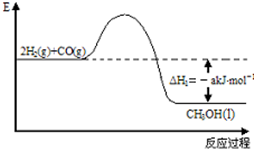
(1)CH3OH的燃烧热△H3=-ckJ•mol-1;燃烧热是可燃物完全燃烧生成稳定氧化物放出的热量,
热化学方程式为:2CH3OH(l)+3O2(g)→2CO2(g)+4H2O(l)△H=-2ckJ•mol-1
故答案为:2CH3OH(l)+3O2(g)→2CO2(g)+4H2O(l)△H=-2ckJ•mol-1
(2)依据甲醇和一氧化碳的燃烧热计算氢气的燃烧热:
①2CH3OH(l)+3O2(g)→2CO2(g)+4H2O(l)△H=-2ckJ•mol-1;
②2CO(g)+O2(g)=2CO2(g)△H=-2bkJ•mol-1;
③2H2(g)+CO(g)=CH3OH(l)△H=-aKJ/mol;
依据盖斯定律,③×2-②+①得到:4H2(g)+2O2(g)=4H2O(l)△H=-(2a-2b+2c)KJ/mol;
依据氢气的燃烧热是1mol氢气完全燃烧生成液态水放出的热量,氢气的燃烧热=
KJ/mol;a+c-b 2
故答案为:
KJ/mola+c-b 2
(3)一些化学键键能如下:C≡O为d kJ/mol;O=O为ekJ/mol;C=O为fkJ/mol.
反应为:2CO(g)+O2(g)=2CO2(g)△H=-2bkJ•mol-1;
反应的焓变=反应物的键能之和-生成物的键能之和=2d+e-2×f×2=△H=-2b
b=2f-d-
;e 2
故答案为:2f-d-
;e 2
(4)H2和CO的混合气体nmol,设氢气为物质的量为X,一氧化碳物质的量为n-X;充分燃烧共放出QkJ热量
2CO(g)+O2(g)=2CO2(g)△H=-2bkJ•mol-1;
2 2b
n-X b(n-X)
2H2(g)+O2(g)=2H2O(l)△H=-(a-b+c)KJ/mol
2 a+c-b
X
(a+c-b) X 2
得到:b(n-X)+
(a+c-b)=Q;x 2
计算得到:X=2bn-2Q 3b-a-c
混合气体中H2和CO的物质的量之比=
:2bn-2Q 3b-a-c
=(2bn-2Q):(bn-an-cn+2Q)bn-an-cn+2Q 3b-a-c
故答案为:(2bn-2Q):(bn-an-cn+2Q);
(5)CO与O2可以组成新型燃料电池,若该电池以Pt为电极,以KOH为电解质溶液,发生的电池反应的离子方程式为:2CO+O2+4OH-=2CO32-+2H2O;
原电池的正极电极反应为:O2+2H2O+4e-=4OH-;用总反应离子方程式减去正极电极反应,化简得到负极电极反应:
CO-2e-+4OH-=CO32-+2H2O;
故答案为:CO-2e-+4OH-=CO32-+2H2O.

