问题
填空题
煤炭可以转化为清洁能源和化工原料.
(1)用煤可以制得水煤气,其反应的化学方程式为______.
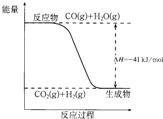
(2)已知一氧化碳与水蒸气反应过程的能量变化如图所示,则此反应为______(填“吸热”或“放热”)反应,反应的热化学方程式为______.
(3)已知 1mol C 完全转化为水煤气时吸收热量 131.5kJ,则1mol C与CO2反应生成CO______(填“吸收”或“放出”)热量______kJ.
答案
(1)用煤可以制得水煤气,其反应的化学方程式为:C(S)+H2O(g)
H2(g)+CO(g); 高温 .
故答案为:C(S)+H2O(g)
H2(g)+CO(g); 高温 .
(2)图象分析判断反应物能量高于生成物的能量,反应是放热反应;反应的焓变为41KJ/mol;反应的热化学方程式为:CO(g)+H2O(g)
CO2(g)+H2(g),△H=-41KJ/mol; 高温 .
故答案为:CO(g)+H2O(g)
CO2(g)+H2(g);△H=-41KJ/mol; 高温 .
(3)1mol C 完全转化为水煤气时吸收热量 131.5kJ,热化学方程式为:①C(S)+H2O(g)
H2(g)+CO(g)△H=131.5KJ/mol; 高温 .
②CO(g)+H2O(g)
CO2(g)+H2(g),△H=-41KJ/mol; 高温 .
依据盖斯定律①-②得到:C(S)+CO2(g)=2CO(g)△H=172.5KJ/mol;
故答案为:吸收;172.5
