I.如图1所示,将2molA气体和1molB气体充入一容积可变的密闭容器中.发生反应:2A(g)+B(g)⇌2C(g).反应开始时可滑动的活塞的位置如图1所示,当反应达到平衡时,活塞位置如图2所示.则达到平衡时,A的转化率为______;该条件下反应的平衡常数为______.
Ⅱ.(1)已知298K时,1molC2H6在氧气中完全燃烧生成二氧化碳和液态水,放出热量1558.3KJ.写出该反应的化学方程式______.
(2)利用该反应设计一个燃料电池:用氢氧化钾溶液做电解 质溶液,用多孔石墨做电极,在电极上分别充入乙烷和氧气.写出负极的电极反应式______.
(3)有化学实验装置如图3,石墨棒上的电极反应式为______;如果起始时盛有1000mLpH=5的硫酸铜溶液(25℃)(CuSO4 足量),一段时间后溶液的pH变为1,若要使溶液恢复到起始浓度(忽略溶液体积的变化),可向溶液中加入______(填物质名称),其质量为______.
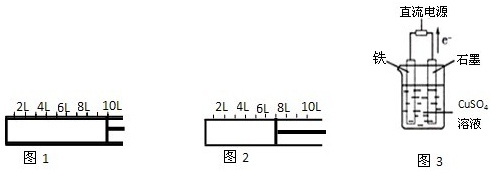
Ⅰ依据图1和图2反应开始和平衡后气体体积之比在相同条件下等于物质的量之比,假设反应过程中消耗A的物质的量为x,列式计算
2A(g)+B(g)⇌2C(g)
起始量(mol) 2 1 0
变化量(mol) x 0.5x x
平衡量(mol) 2-x 1-0.5x x
得到 ( 2-x+1-0.5x+x):(2+1)=7:10
求的x=1.8mol
A的转化率=
×100%=90%1.8 2
平衡时ABC的浓度为
[A]=
=(2-1.8)mol 7L
mol/L2 7
[B]=
=(1-0.5×1.8)mol 7L
mol/L0.1 7
[C]=
=1.8mol 7L
mol/L1.8 7
则化学平衡常数K=
=[C]2 [A]2[B]
=56.7L•mol-1(
)21.8 7 (
)2×2 7 0.1 7
故答案为:90%;56.7L•mol-1;
Ⅱ(1)1molC2H6在氧气中完全燃烧生成二氧化碳和液态水,放出热量1558.3KJ,依据化学方程式的书写,2mol乙烷燃烧放热3116.6KJ,根据书写热化学方程式的要求写出热化学方程式为:
2C2H6(g)+7 O2(g)=4CO2(g)+6H2O (l)△H=-3116.6KJ•mol-1
(2)用氢氧化钾溶液做电解质溶液,用多孔石墨做电极,在电极上分别充入乙烷和氧气,乙烷在负极发生氧化反应,氧气再正极发生还原反应,在强碱溶液中进行,写出总的化学方程式为
2C2H6+7 O2+8OH-=4CO32-+10H2O,正极反应容易写出为7O2+14H2O+28e-=28OH-,用总反应减去正极反应,消去氧气得到负极的电极反应式为C2H6+18 OH-→2CO32-+12H2O+14e-
(3)装置中的电子流向判断石墨为阳极,铁为阴极,电解质溶液中的氢氧根离子在阳极放电,电极反应为4OH-→2H2O+O2↑+4e-;阴极电极反应为Cu2++2e-=Cu
起始时盛有1000mLpH=5的硫酸铜溶液(25℃)(CuSO4 足量),一段时间后溶液的pH变为1,若要使溶液恢复到起始浓度(忽略溶液体积的变化),反应的化学方程式为2CuSO4+2H2O
2Cu+2H2SO4+O2↑根据PH的变化可知生成的硫酸近似为0.05mol,消耗硫酸铜0,05mol,消耗水0.05mol,所以需要加入与硫酸反应能生成硫酸铜0,05mol,水0.05mol的物质,所以加入氧化铜或碳酸铜等,需要氧化铜的质量=0.05mol×80g/mol=4g;需要碳酸铜的质量=0.05mol×124g/mol=6.2g; 通电 .
故答案为:(1)2C2H6(g)+7 O2(g)=4CO2(g)+6H2O (l)△H=-3116.6KJ•mol-1
(2)C2H6+18 OH-→2CO32-+12H2O+14e-
(3)4 OH-→2 H2O+O2↑+4e-氧化铜 4g[或碳酸铜 6.2g]
