现已确认,CO、SO2和NOx的排放是造成大气污染的重要原因.
(1)用CO2和氢气合成CH3OH具有重要意义,既可以解决环境问题,还可解决能源危机.已知CH3OH具有重要意义,既可以解决环境问题,还可解决能源危机.已知CH3OH、H2的燃烧热分别为-726.5kJ/mol、-285.8kJ/mol,写出工业上用CO2和H2合成CH3OH的热化学方程式:______.
(2)用铂作电极,一极通入空气,一极通入CH3OH(l),与KOH溶液可组成燃料电池,其负极反应式为______.溶液中的阴离子向______极定向移动.
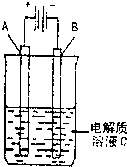
(3)如图是一个电化学装置示意图,用CH3OH-空气燃料电池作此装置的电源.
①如果A为粗铜,B为纯铜,C为CuSO4溶液.该原理的工业生产意义是______.
②如果A是铂电极,B是石墨电极,C是AgNO3溶液.通电后,若B极增重10.8g,该燃料电池理论上消耗______mol甲醇.(计算
结果保留两位有效数字)
(4)常温下向1L、0.2mol/L NaOH溶液中通入4.48L(标准状况)的SO2(忽略混合后溶液体积的变化),若测得溶液的pH<7,则溶液中c(SO32-)_______c(H2SO3)(填“>”、“<”、或“=”).有关该溶液中离子浓度关系的判断正确的是______(填字母编号).
A.c(SO32-)十c(OH-)+c(HSO3-)=c(Na+)+c(H+)
B.c(H2SO3)+c(HSO3-)+c(SO32-)=0.2mol/L
C.c(H2SO3)+c(H+)=c(SO32-)十c(OH-)
D.c(Na+)>c(H+)>c(HSO3-)>c(OH-)
(1)甲醇和氢气的燃烧热书写其热化学方程式分别为:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l),△H1=-1453kJ/mol;
②2H2(g)+O2(g)=2H2O(l),△H2=-571.6KJ/mol,
根据盖斯定律,反应CO2(g)+3H2(g)═CH3OH(l)+H2O(l)
可以看成是方程式
×②-①×3 2
,所以△H=1 2
×(-571.6KJ/mol)-(-1453kJ/mol)×3 2
=-130.9KJ/mol,1 2
故答案为:CO2(g)+3H2(g)═CH3OH(l)+H2O(l),△H=-130.9KJ/mol;
(2)在甲醇燃料电池中,负极上是燃料甲醇失电子的反应,当电解质是KOH溶液时,
电极反应为:CH3OH-6e-+8OH-=6H2O+CO32-,电解质中的阴离子向负极移动,
故答案为:CH3OH-6e-+8OH-=6H2O+CO32-;负;
(3)①如果阳极为粗铜,阴极为纯铜,电解质为CuSO4溶液的电解池可以实现粗铜中金属铜的精炼,即电解精炼金属铜,故答案为:精炼粗铜;
②A是铂电极,B是石墨电极,C是AgNO3溶液.通电后,B极上的电极反应为:Ag++e-=Ag,当质量增重10.8g时,转移电子0.1mol,根据甲醇燃料电池的总反应式:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l),可知当转移12mol电子时,消耗甲醇的物质的量为2mol,所以当转移0.1mol电子时,消耗甲醇的物质的量为
≈0.017mol,0.2 12
故答案为:0.017;
(4)常温下向1L、0.2mol/L NaOH溶液中通入4.48L(标准状况)的SO2(忽略混合后溶液体积的变化)时,所得的溶液为0.2mol/L的亚硫酸氢钠,溶液显酸性,说明亚硫酸氢根的电离程度大于水解程度,A、根据电荷守恒得:2c(SO32-)十c(OH-)+c(HSO3-)=c(Na+)+c(H+),故A错误;
B.根据物料守恒得:c(H2SO3)+c(HSO3-)+c(SO32-)=0.2mol/L,故B正确;
C.根据质子守恒得:c(H2SO3)+c(H+)=c(SO32-)十c(OH-),故C正确;
D.溶液中的离子浓度大小关系为:c(Na+)>c(HSO3-)>c(H+)>c(OH-),故D错误.
故选BC.

