甲醇是一种非常好的燃料.熔点-97.8°C,沸点64.5°C.一定条件下,CO与H2反应可制得甲醇:CO+2H2

CH3OH
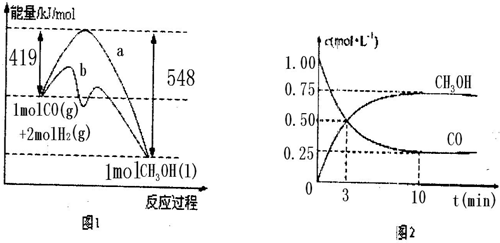
图1表示该反应进行过程中的能量变化;图2表示100°C,在体积为2L的恒容容器中加入4molH2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化情况.
(1)已知CO的燃烧热为283kJ/mol,H2的燃烧热为285.8kJ/mol,写出表示CH3OH燃烧热的热化学方程式______.
(2)根据上图2计算:该温度下,反应CO(g)+2H2(g)

CH3OH(g)△H<0的平衡常数为______;10min后,容器内的压强变为原来的______倍;改变下列条件,能提高CO转化率的是______.
A.降低温度B.加催化剂
C.充入氩气,使体系压强增大D.再充入1molCO和2molH2
E.恒温恒容改为恒温恒压.
(1)CO的燃烧热为283kJ/mol,则CO的与氧气反应的热化学方程式为
CO(g)+
O2(g)═CO2(g);△H=-283kJ/mol①1 2
H2的燃烧热为285.8kJ/mol,则H2与氧气反应的热化学方程式为H2(g)+
O2(g)═H2O(l);△H=-285.8kJ/mol②1 2
由图1可知,CO与H2反应可制得甲醇的热化学方程式为:CO(g)+2H2(g)═CH3OH(l);△H=-129kJ/mol③
根据盖斯定律,则CH3OH燃烧热的热化学方程式由①+②×2-③可得:
CH3OH(l)+
O2(g)=CO2(g)+2H2O(l);△H=-725.6mol/L,3 2
故答案为:CH3OH(l)+
O2(g)=CO2(g)+2H2O(l);△H=-725.6mol/L;3 2
(2)根据平衡时CO的浓度为0.25mol/L可知,反应消耗的H2物质的量为2×2L×0.75mol/L=3mol,则平衡时H2的物质的量浓度为0.5mol/L,根据平衡常数等于生成的浓度幂之积除以反应物的浓度幂之积可得,
k=
=c(CH3OH) c(CO)•c2(H2)
=12(mol/L)-2;0.75mol/L 0.25mol/L×(0.5mol/L)2
平衡时n(CO)=0.5mol,n(H2)=1mol,n(CH3OH)=1.5mol,共3mol,
起始时,n(CO)=2mol,n(H2))=4mol,共6mol,
根据阿伏加德罗定律可知压强之比等于物质的量之比,10min后,容器内的压强变为原来的
=3 6
倍,1 2
A.因正反应放热,降低温度可使平衡向正反应方向移动,提高CO的转化率,故A正确;
B.加催化剂,平衡不移动,转化率不变,故B错误;
C.充入氩气,使体系压强增大,对于参加反应的物质来说,浓度不变,平衡不移动,转化率不变,故C错误;
D.再充入1molCO和2molH2压强增大,平衡向正反应方向移动,提高CO的转化率,故D正确;
E.恒温恒容改为恒温恒压,压强较恒容时大,增大压强,平衡向正反应方向移动,提高CO的转化率,故E正确.
故答案为:12(mol/L)-2;
;ADE.1 2
