如图1所示是工业生产硝酸的流程:
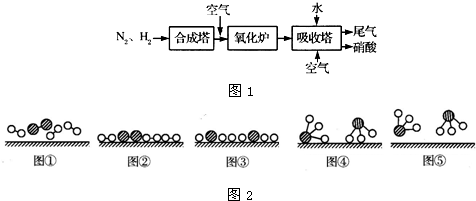
合成塔中内置铁触媒,氧化炉中内置Pt-Rh合金网.请回答下列问题:
(1)1909年化学家哈伯在实验室首次合成了氨.2007年化学家格哈德•埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意如图2所示.
、
、

分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是______.
(2)合成氨反应的化学方程式为N2(g)+3H2(g)⇌2NH3(g),写出该反应的化学平衡常数表达式K=______.在一定温度和压强下,将H2 和N2 按3:1(体积之比)混合后进入合成塔,反应达到平衡时,平衡混合气中NH3 的体积分数为15%,此时H2 的转化率为______.
(3)已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=-1 266.8kJ/mol
N2(g)+O2(g)=2NO(g)△H=+1 80.5kJ/mol,氨催化氧化的热化学方程式为______.
(4)吸收塔中通入空气的目的是______.
(1)、分析题中图可以知道,图②表示N2、H2被吸附在催化剂表面,而图③表示在催化剂表面,N2、H2中化学键断裂,故答案为:图②表示N2、H2被吸附在催化剂表面,图③表示在催化剂表面,N2、H2中化学键断裂;
(2)、化学平衡常数是:在特定物理条件下(如温度、压力、溶剂性质、离子强度等),可逆化学反应达到平衡状态时生成物与反应物的浓度比或反应物与反应产物的浓度比.根据以上概念可以写出该反应的化学平衡常数表达式 K=
,有反应方程式:N2(g)+3H2(g)⇌2NH3(g),设参加反应的氢气的物质的量xmol,原混合气体中 H2 和N2 按3:1(体积之比)混合,物质的量之比也是3:1,设氢气3nmol,氮气nmol,则参加反应的氮气的物质的量为x/3mol,生成的氨气为2x/3mol,列式:c2(NH3) c(N2).c3(H2)
=15%,解得x≈0.78nmol,H2 的转化率为:0.78nmol÷3nmol×100%=26%,2X/3 n-x/3+3n-x+2x/3
故答案为:K=
; 26%;c2(NH3) c(N2).c3(H2)
(3)、已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=-1 266.8kJ/mol ①
N2(g)+O2(g)=2NO(g)△H=+1 80.5kJ/mol ②
①+②×2得:4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905.8kJ/mol
故答案为:4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905.8kJ/mol;
(4)、不断通入空气,提供充足的氧气,以便使NO循环利用,全部转化成硝酸.
故答案为:使NO循环利用,全部转化成硝酸.
