(1)经测定,20g氢气在氧气中燃烧生成水蒸气,放热2418.0kJ,写出该反应的热化学方程式______;已知:3Fe (s)+2O2(g)═Fe3O4(s)△H=-1118.4kJ•mol-1,根据以上信息,则反应 3Fe(s)+4H2O(g)═Fe3O4(s)+4H2(g) 的△H=______
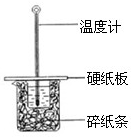
(2)某学生实验小组用50mL0.50mol•L-1的盐酸与50mL0.50mol•L-1的NaOH溶液在右图所示的装置中进行中和反应反应热的测定
①图中装置缺少的一种仪器,该仪器名称为______.
②将反应混合液的______温度记为反应的终止温度.
③下列说法正确的是______
A.小烧杯内残留有水,会使测得的反应热数值偏小
B.可用相同浓度和体积的醋酸代替稀盐酸溶液进行实验
C.烧杯间填满碎纸条的作用是固定小烧杯
D.酸、碱混合时,应把量筒中的溶液缓缓倒入烧杯的溶液中,以防液体外溅.
(1)①2H2(g)+O2(g)=2H2O(g)△H=-483.6KJ/mol,
②3Fe (s)+2O2(g)═Fe3O4(s)△H=-1118.4kJ•mol-1,
依据盖斯定律②-①×2得到:3Fe(s)+4H2O(g)═Fe3O4(s)+4H2(g)△H=-151.2KJ/mol;
故答案为:-151.2KJ/mol;
(2)①根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌器,故答案为:环形玻璃搅拌器;
②用玻璃棒轻轻搅动溶液,并准确读取混和溶液的最高温度作为终止温度.
故答案为:最高温度;
③A.小烧杯内残留有水,没有干燥,会使体积无形中变多了,这样就会使最后的实验值变小,因为一部分散发的热量是要把给未擦干的水加热的会使测得的反应热数值偏小,故A正确;
B.醋酸是弱电解质存在电离平衡过程是吸热过程,随反应进行,反应放出的热量减小,所以不可用相同浓度和体积的醋酸代替稀盐酸溶液进行实验,故B错误;
C.烧杯间填满碎纸条的作用以达到保温、隔热和减少实验过程中热量损失的目的,不是固定小烧杯作用,故C错误;
D.酸、碱混合时,应把量筒中的溶液迅速倒入烧杯的溶液中,以防温度散失造成测定结果产生误差,故D错误;
故选A.
