铁和铁的化合物在工业生产和日常生活中都有广泛的用途.
(1)在定向爆破中,常利用氧化铁与铝反应放出的热量来切割钢筋,该反应的化学方程式为______.
(2)已知2FeO3(s)+3C(s)═3CO2(g)+4Fe(s)△H=+468.2kJ•mol-1,C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1,则Fe(s)与O2(g)反应生成Fe2O3(s)的热化学方程式为______.
(3)可用KMnO4溶液滴定Fe2+的浓度,反应的离子方程式如下:5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O
①KMnO4溶液应盛放在______滴定管中;
②判断达到滴定终点的现象是______;
③用硫酸酸化的0.02000mol•L-1 KMnO4溶液滴定某FeSO4溶液至终点,实验数据记录如下表:
| 滴定序号 | 待测液体积∕mL | 消耗KMn0溶液体积∕mL |
| 1 | 25.00 | 19.98 |
| 2 | 25.00 | 19.12 |
| 3 | 25.00 | 20.02 |
(4)新型纳米材料ZnFe2Ox,可用于除去工业废气中的某些氧化物.制取新材料和除去废气的转化关系如图:
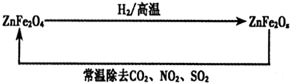
①已知ZnFe2O4与H2反应的物质的量之比为2:1,则ZnFe2Ox中x=______;
②用ZnFe2Ox除去SO2的过程中,氧化剂是______.
(1)铝和氧化铁在点燃的条件下能生成氧化铝和铁,而且该反应放出了大量的热,反应方程式为2Al+Fe2O3
2Fe+Al2O3,高温 .
故答案为:2Al+Fe2O3
2Fe+Al2O3;高温 .
(2)①2Fe2O3(s)+3C(s)═3CO2(g)+4Fe(s)△H=+468.2kJ•mol-1,
②C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
根据盖斯定律,②×3-①得:4Fe(s)+3O2(g)═2Fe2O3(s)
△H=3×(-393.5kJ•mol-1)-468.2kJ•mol-1=-1648.7kJ•mol-1,
故答案为:4Fe(s)+3O2(g)═2Fe2O3(s)△H=-1648.7kJ•mol-1;
(3)①KMnO4溶液具有强氧化性,可以腐蚀橡皮管,应装在酸式滴定管中,故答案为:酸式;
②FeSO4反应完毕,加入最后一滴KMnO4溶液,溶液变为浅紫红色,浅紫红色半分钟内不褪去,说明滴定到终点,
故答案为:溶液变为浅紫红色,且半分钟内红色不褪去;
第2组KMnO4溶液的体积与第1、3组相差比较大,应舍掉,应按第1、3组计算消耗KMnO4溶液的体积,
故消耗KMnO4溶液的体积为
mL=20mL,令FeSO4溶液的浓度为cmol/L,19.98+20.02 2
由KMnO4~5FeSO4可知:5×20mL×0.02000mol•L-1=25mL×cmol/L,解得c=0.0800;
故答案为:0.0800mol•L-1;
(4)①ZnFe2O4与H2反应的物质的量之比为2:1,令ZnFe2OX中铁元素的化合价为a,根据电子转移守恒,
可知2mol×2×(3-a)=1mol×2,解得,a=2.5;利用化合价代数和为零,2+2.5×2=2x,解得x=3.5,故答案为:3.5;
②新型纳米材料ZnFe2OX可由化合物ZnFe2O4经高温还原制得,故ZnFe2OX和SO2反应得到ZnFe2O4过程中铁的化合价升高,也可由①计算可知,故ZnFe2OX作还原剂,则SO2作氧化剂,故答案为:SO2.
