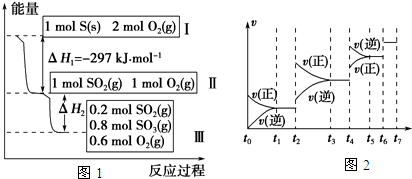
2013年,央视《经济半小时》曝光了部分药企用工业硫磺熏制山银花以及没有功效的山银花杂质入药,其中包括广药集团旗下药厂生产的维C银翘片.维C银翘片被曝光“涉硫”后,给中药制药企业敲响了警钟.在恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示.(已知:2SO2(g)+O2(g)⇌2SO3(g),△H=-196.6KJ/mol)
请回答下列问题:
(1)写出能表示固体硫的燃烧热的热化学方程式:______.
(2)恒温恒容时,lmol SO2和2mol O2充分反应,放出热量的数值比|△H2|______(填“大”、“小”或“相等”)
(3)将Ⅲ中的混合气体通入足量的NaOH溶液中消耗NaOH的物质的量为______,若溶液中发生了氧化还原反应,则该过程的离子方程式为______.
(4)某SO2(g)和O2(g)体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图2所示,若不改变SO2(g)和O2(g)的量,则图中t4时引起平衡移动的条件可能是______;图中表示平衡混合物中SO3的百分含量最高的一段时间是______.
(5)各阶段平衡时对应的平衡常数如下表所示:
| t1-t2 | t3-t4 | t5-t6 | t6-t7 |
| K1 | K2 | K3 | K4 |
(1)燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物放出的热量,所以,硫的物质的量为1mol.由图1可知1molS(s)完全燃烧放出的热量为297KJ,所以,硫的燃烧热的热化学方程式S(s)+O2(g)═SO2(g)△H=-297 KJ•mol-1;
故答案为:S(s)+O2(g)═SO2(g)△H=-297 KJ•mol-1;
(2)恒温恒容时,开始为1molSO2和2molO2 与开始为1molSO2和1molO2 相比,增大氧气的浓度,平衡正向移动,所以开始为1molSO2和2molO2 的SO2转化率高,放出热量的数值比|△H2|大;
故答案为:大;
(3)反应最后得到硫酸钠,根据钠原子、硫原子原子守恒,n(NaOH)=2n(S)=2×(0.2+0.8)mol=2mol.
若发生氧化还原反应,则是SO2被O2氧化,离子方程式为2SO2+O2+4OH-═2SO42-+2H2O.
故答案为:2mol;2SO2+O2+4OH-═2SO42-+2H2O;
(4)t2~t3段正逆速率都加快,且v(正)>v(逆),平衡正向移动;t4~t5段正逆速率都加快,且v(正)<v(逆),平衡逆向移动;该反应为体积减小的放热反应,若升高温度,平衡逆向移动,若增大压强,平衡正向移动,所以t2~t3段为增大压强,t4~t5段为升高温度;t2~t3段为增大压强后,平衡正向移动,SO3的含量升高,至t3~t4平衡时含量达最高;
故答案为:升高温度;t3~t4;
(5)由(4)的分析可知t2~t3段为增大压强,则K2=K1;t4~t5段为升高温度,则K3<K2;所以K4=K3<K2=K1;
故答案为:K4=K3<K2=K1.
