关于如图,下列说法正确的是( )
A.1mol H2(g)所含的能量比2 mol H(g) 所含的能量高
B.断裂1molH-Cl键能放出431 KJ的热量
C.该反应的热化学方程式为:H2(g)+Cl2(g)→2HCl(g)+183KJ
D.常温下,H2(g)与Cl2(g)混合就能反应生成HCl
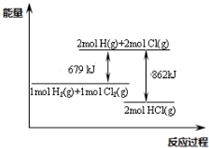
A、原子能量高于分子,1mol H2(g)所含的能量比2 mol H(g) 所含的能量低,故A错误;
B、断裂化学键需要吸收能量,断裂1molH-Cl键能吸收431 KJ的热量,故B错误;
C、图象分析判断反应的焓变=断裂反应物化学键吸收的能量-生成物形成化学键所放出的能量=679KJ/mol-862KJ/mol=-183KJ/mol;热化学方程式为:H2(g)+Cl2(g)→2HCl(g)
△H=-183KJ/mol;也可以表示为H2(g)+Cl2(g)→2HCl(g)+183KJ,故C正确;
D、常温下,H2(g)与Cl2(g)混合在一定条件下能反应生成HCl,故D错误;
故选C.

