已知:1molC、1molCO分别按下式反应(燃烧):
①C(s)+
O2(g)=CO(g)放热110.5kJ1 2
②CO(g)+
O2(g)=CO2(g)放热283.0kJ1 2
③C(s)+O2(g)=CO2(g)放热393.5kJ
请回答:
(1)根据上述反应及数据,煤炭充分燃烧具有的优点是______.
a.放出热量多节约能源
b.减少对环境的污染
(2)根据反应②,断开1molCO(g)与0.5molO2(g)中的化学键所吸收的能量,比形成1molCO2(g)中的化学键所放出的能量______(填“多”或“少”).
(3)在图中画出反应③能量随反应过程的变化曲线.
(4)单质碳通过先与氧气反应生成CO(g),再与氧气反应生成CO2(g),所放出的热量之和与相同质量的碳与氧气完全反应生成CO2(g)所放出的热量的关系是______(填“相等”或“不等”).

(1)结合数据和反应产物说明,可知煤炭充分燃烧产生的热量多和产物无污染,故答案为:产生的热量多;产物无污染,故答案为:ab;
(2)反应②是放热反应,断开1molCO(g)与0.5molO2(g)中的化学键所吸收的能量,比形成1molCO2(g)中的化学键所放出的能量少;
故答案为:少;
(3)反应③是放热反应,反应物能量高于生成物能量依据能量高低和变化画出能量曲线变化,如图
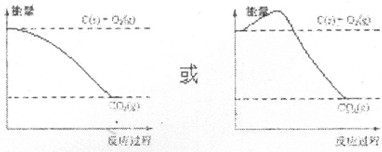 ,故答案为:
,故答案为: ;
;
(4)已知:①C(S)+1/2O2(g)=CO(g)△H=-110.5KJ•mol-1,
②CO(g)+1/2O2(g)=CO2(g)△H=-283.0KJ•mol-1,
利用盖斯定律将①+②可得C(S)+O2(g)=CO2(g)△H=(-110.5kJ•mol-1)+(-283.0kJ•mol-1)=-393.5KJ•mol-1,
即单质碳通过先与氧气反应生成CO(g),再与氧气反应生成CO2(g),所放出的热量之和等于相同质量的碳与氧气完全燃烧生成CO2(g)所放出的热量,
故答案为:相等.
