问题
多选题
下图是炭和水蒸汽发生反应生成CO、H2的途径和三个状态的能量,该反应为吸热反应.
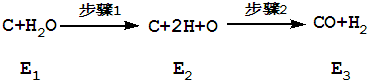
下列说法不正确的是( )
A.步骤1为吸热反应,步骤2为放热反应
B.E3>E2>E1
C.1mol C发生该反应时吸收的能量为E3-E1
D.E2-E1<E2-E3
答案
A.①步骤l中化学键断裂形成原子,应是吸热过程,步骤2是原子之间形成化学键生成新物质,放出热量,故A正确;
B.步骤1为吸热过程,故E2>E1,步骤2是放热过程,故E2>E3,由于炭和水蒸汽发生反应生成CO、H2为吸热反应,故E1>E3,故E2>E1>E3,故B错误;
C.炭和水蒸汽发生反应生成CO和H2:C+H2O=CO+H2△H=(E3-E1)kj/mol,1mol C发生该反应时吸收的能量为E3-E1,故C正确;
D.炭和水蒸汽发生反应生成CO、H2是吸热反应,所以反应中化学键断裂形成原子需要吸收能量大于原子之间形成化学键放出能量,即E2-E1>E2-E3,故D错误;
故选BD.
