能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和
应用前景.工业上合成甲醇的反应为:CO(g)+2H2(g)⇌CH3OH(g);△H
(1)已知,该反应在300℃,5MPa条件下能自发进行,则△H______0,△S______0(填“<,>或=”).
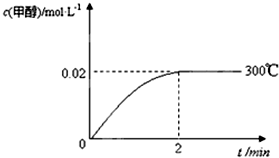
(2)在300℃,5MPa条件下,将0.20mol的CO与0.58molH2的混合气体充入2L密闭容器发生反应,反应过程中甲醇的物质的量浓度随时间的变化如图所示.
①在0~2min内,以H2表示的平均反应速率为______mol•L-1•s-1,CO的转化率为______.
②列式计算300℃时该反应的平衡常数K=______.
③300℃时,将0.50molCO、1.00molH2和1.00molCH3OH充入容积为2L的密闭容器中,此时反应将______.
A.向正方向移动B.向逆方向移动C.处于平衡状态D.无法判断
④下列措施可增加甲醇产率的是______.
A.压缩容器体积B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入0.20molCO和0.58molH2
(3)若其它条件不变,使反应在500℃下进行,在图中作出甲醇的物质的量浓度随时间的变化的示意图.
(1)该反应的反应物有3mol气体,生成物有1mol气体,所以△S<0,反应自发进行△H-T△S<0,故△H必须小于0,故答案为:<;<;
(2)①2min时,甲醇浓度变化0.02mol/L,则氢气浓度变化为0.04mol/L,v(H2)=
=△c(H2) △t
=0.02mol/(L•min)-10.04mol/L 2min
从图象分析,生成甲醇0.04mol,则反应的CO为0.04mol,α(CO)=
×100%=20%,0.04mol 0.20mol
故答案为:0.02;20%;
②CO(g)+2H2(g)⇌CH3OH(g)
加入的(mol/L) 0.10 0.29 0
反应的(mol/L) 0.02 0.04 0.02
平衡后(mol/L) 0.08 0.25 0.02
K=
=c(CHOH) c(CO)•c2(H2)
=4(mol/L)-20.02mol/L 0.08mol/L×0.25mol/L2
故答案为:K=
=c(CHOH) c(CO)•c2(H2)
=4(mol/L)-2;0.02mol/L 0.08mol/L×0.25mol/L2
③Qc=K=
=c(CHOH) c(CO)•c2(H2)
=8>K=4,所以平衡逆向移动,选B,0.50 0.25×0.502
故答案为:K=
=c(CHOH) c(CO)•c2(H2)
=4(mol/L)-2; B;0.02mol/L 0.08mol/L×0.25mol/L2
④A、对于反应CO(g)+2H2(g)⇌CH3OH(g),反应物气体体积大于生成物,压缩容器体积 时,压强增大,平衡正向移动,可增加甲醇产率,A正确;
B、分离出甲醇,平衡正向移动可增加甲醇产率,故B正确;
C、充入He,不影响各气体的分压,平衡不移动,不能增加甲醇产率,故C错误;
D、体积不变,再充入反应物气体,平衡正向移动,可增加甲醇产率,故D正确.
故选:A B D;
(3)温度升高,反应速率加快,达到平衡时间短.正反应放热,升温时平衡逆向移动,平衡时甲醇浓度比300℃低,可得下图: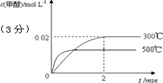
故答案为: .
.
