问题
计算题
已知:2SO2(g)+O2(g)= 2SO3(g) △H=-196.6 kJ·mol-1,计算每生产1万吨98%的硫酸所需要的SO3的质量和由SO2生产这些SO3所放出的热量。
答案
SO2 ~ SO3 ~ H2SO4 ~ 反应热
80 98
196.6kJ/2 m(SO3) 104×106g×98% Q
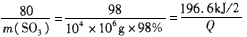
解得 :m( SO3)=8.0×109g=8.0×103t,
Q=9.83×109kJ。
已知:2SO2(g)+O2(g)= 2SO3(g) △H=-196.6 kJ·mol-1,计算每生产1万吨98%的硫酸所需要的SO3的质量和由SO2生产这些SO3所放出的热量。
SO2 ~ SO3 ~ H2SO4 ~ 反应热
80 98
196.6kJ/2 m(SO3) 104×106g×98% Q
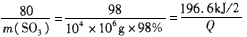
解得 :m( SO3)=8.0×109g=8.0×103t,
Q=9.83×109kJ。