25℃时,在1L的密闭容器中充入NO2发生如下反应:2NO2(g)⇌N2O4(g)△H=-57kJ•mol-1(N2O4在25℃时为无色气体).
(1)该反应的△S______0(填“>”、“<”或“=”).
(2)当开始充入0.03mol的NO2时,25℃时,实验测得NO2的平衡浓度为0.01mol•L-1,则NO2的平衡转化率(α)是______.25℃时上述反应的平衡常数K=______.
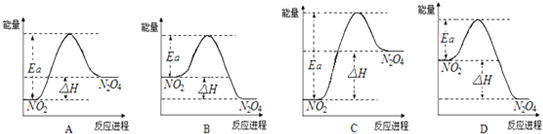
(3)25℃时,实验测得该反应的活化能Ea=92.4kJ•mol-1.下列能量关系图合理的是______.
(4)如把该密闭容器放入80℃的热水中,则气体的颜色______(填“不变”、“加深”或“变浅”),NO2的转化率______(填“增大”、“不变”或“减小”).
(1)2NO2(g)⇌N2O4(g)△H=-57kJ•mol-1,依据反应分析可知反应后气体体积减小,所以熵变小于0,△S<0,故答案为:<;
(2)在1L的密闭容器中充入NO2发生如下反应:2NO2(g)⇌N2O4(g)△H=-57kJ•mol-1,当开始充入0.03mol的NO2时,25℃时,实验测得NO2的平衡浓度为0.01mol•L-1,依据化学平衡三段式列式计算:二氧化氮起始浓度为0.03mol/L,
2NO2(g)⇌N2O4(g)
起始量(mol/L) 0.03 0
变化量(mol/L) 0.02 0.01
平衡量(mol/L) 0.01 0.01
NO2的平衡转化率(α)=
×100%=66.7%,0.02mol/L 0.03mol/L
平衡常数K=
=[N2O4] [NO2]2
=100L/mol;0.01mol/L (0.01mol/L)2
故答案为:66.7%;100L/mol;
(3)依据反应是放热反应,二氧化氮能量高于四氧化二氮分析,结合图象分析活化能数值大于反应焓变判断,B符合;AC中二氧化氮能量低于四氧化二氮,错误;D选项活化能数值小于反应焓变,错误;故答案为:B;
(4)2NO2(g)⇌N2O4(g)△H=-57kJ•mol-1,反应是放热反应,二氧化氮是红棕色气体,四氧化二氮是无色气体,放在80℃的热水中,平衡逆向进行,气体颜色加深,NO2的转化率减小;故答案为:加深;减小.