(1)下列各组热化学方程式中的△H前者大于后者的是___
①C(s)+O2(g)==CO2(g) △H1 C(s)+1/2O2(g)==CO(g) △H2
②S(g)+O2(g)==SO2(g) △H3 S(s)+O2(g)==SO2 (g) △H4
③H2 (g)+1/2O2(g)==H2O(g) △H5 2H2(g)+O2(g)==2H2O(g) △H6
④CaCO3(s)==CaO(s)+CO2(g) △H7 CaO(s)+H2O(l)==Ca(OH)2 (s) △H8
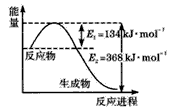
(2)下图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式____。
(3)在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应N2(g)+3H2(g) 2NH3(g) △H<0,其化学平衡常数K与温度t的关系如下表:
2NH3(g) △H<0,其化学平衡常数K与温度t的关系如下表:

①试比较:K1___K2(填“>”、“=”或“<”)。
②400℃时,反应2NH3(g)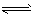 N2(g)+3H2(g)的化学平衡常数的值为___
N2(g)+3H2(g)的化学平衡常数的值为___
(4)硫酸生产中,SO2催化氧化成SO3:2SO2(g)+O2(g)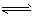 2SO3(g) △H<0某温度下,SO2的平衡转化率(a)与体系总压强(p)的关系如下图所示。根据图示回答下列问题:
2SO3(g) △H<0某温度下,SO2的平衡转化率(a)与体系总压强(p)的关系如下图所示。根据图示回答下列问题:
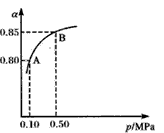
①将2. 0mol SO2和1.0mol O2置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa。该反应的平衡常数等于___。
②平衡状态由A变到B时,平衡常数K(A)____K(B)(填“>”、“<”或“=”)。
(1)③④
(2)NO2(g)+CO(g)=CO2(g) + NO ( g) △H = -234kJ . mol-1
(3)< ;2
(4)① 800; ② =
