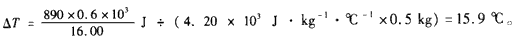问题
计算题
质量为8.00 g的某气体,含有3.01×1023个分子,其分子是由碳和氢两种元素的原子构成,实验测得1 mol该气体完全燃烧生成液态水和二氧化碳,能放出890 kJ的热量。
(1)写出该气体的化学式,并写出其完全燃烧的热化学方程式。
(2)0.60 g该气体完全燃烧放出的热量能使500 g 20℃的水温度升高多少?(已知水的比热容是4.20×103 J·kg-1·℃-1)
答案
(1)由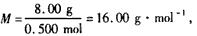 可确定该有机物为CH4。
可确定该有机物为CH4。
CH4(g)+2O2(g)=CO2(g)+ 2H2O(l) △H=-890 kJ·mol-1。
(2)根据 CH4 ~ △H
16. 00 g ~ 890 kJ
0.6 g Q
则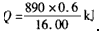 .
.
根据Q=cm△T得