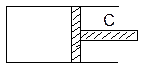问题
计算题
合成氨工业用氢和氮在催化剂作用下直接合成,下表表示在一定温度和压强作用下达到动态平稳时氨的含量。
达到平稳时混合气体中氨的含量(体积百分比)(氮气和氢气的体积比是1:3)
  氨含量 P(大气压) 氨含量 P(大气压)t(℃) | 100 | 200 | 300 | 600 | 1000 |
| 200 | 81.5 | 86.4 | 89.9 | 95.4 | 98.8 |
| 300 | 52.0 | 64.2 | 71.0 | 84.2 | 92.6 |
| 400 | 25.1 | 38.2 | 47.0 | 65.2 | 79.8 |
| 500 | 10.6 | 19.1 | 26.4 | 42.2 | 57.5 |
|
300大气压的氮气11.2L充入容器中,当两者反应达到动态平稳
时,若保持混合气体的温度和压强仍为400℃和300大气压,求:
(1)容器是向外界放热,还是吸热?为什么?
(2)试计算充入容器中氮气质量是多少克?
(3)活塞C要向左侧移动的距离与容器全长之比是多少?
答案
(1)该反应是放热反应,若保持反应时温度不变,容器必须向外界放热.
(2) 1.7×103g
(3)活塞C向左移动距离与活塞全长之比为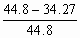 =0.24
=0.24
(1)由表中查出在400oC、300大气压条件下氢、氮混合达到动态平衡时的氨的含量为47%。
氢和氮反应方程如下
N2+3H2 2NH3+92.4kJ
2NH3+92.4kJ
该反应是放热反应,若保持反应时温度不变,容器必须向外界放热.
(2)因为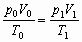
所以V0=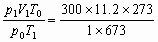 =1363L,则
=1363L,则
m=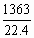 ×28=1.7×103g
×28=1.7×103g
(3)动态平衡时氢和氮的含量均为53%,其总体积为V'=(33.6+11.2)×0.53=23.74L
反应后生成氨的体积为
V"=(33.6+11.2)×0.47÷2=10.53L
则反应后总体积为
V=V'+V"=34.72L
活塞C向左移动距离与活塞全长之比为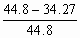 =0.24
=0.24