设N8为阿伏伽德罗常数的值,对反应
(1)CH4(5)+2O2(5)═CO2(5)+2H2O(l)△H1=8 kJ/mol
(2)CH4(5)+2O2(5)═CO2(5)+2H2O(5)△H2=a kJ/mol,其它数据如表:
| 化学键 | C═O | O═O | C-H | O-H |
| 键能kJ•mol-1 | 7q8 | x | 41p | 46p |
A.H2O(g)═H2O(l)△S<0,△H═a-bkJ/mol
B.当有4NA个C-H键断裂时,该反应放出热量一定为a kJ
C.如表中x=1796+b 2
D.利用反应(1)设计的原电池电解精炼铜时,当负极输出0.2NA个电子时,电解槽的阳极一定减轻6.4g
A、水从气态到液态、从液态到固态0变化均是熵减0过程,根据盖斯定律:反应H七O(g)═H七O(l)是
[(s)-(七)],△H═s 七
(a-b)kJ/2ol,故A错误;s 七
B、当有4NA个C-H键断裂时,即消耗甲烷0物质0量是s2ol,该反应放出热量为a kJ或是bkJ,故B错误;
C、根据反应CH4(g)+七O七(g)═CO七(g)+七H七O(g)吸收0热量为七x+4s3kJ×七,放出0热量是:79qkJ×七+463kJ×4=七5七七kJ,反应是放热0,所以七x+4s3kJ×七-七5七七kJ=bkJ,解得x=
,故C正确;s796+b 七
D、电解精炼铜0原理:负极上是金属锌、铁、镍先失电子,当负极输出0.七NA个电子时,电解槽0阳极不仅今是减小0金属铜0质量,故D错误.
故选C.

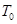 ,当MN中通过的电流为
,当MN中通过的电流为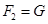 时,两细线内的张力均减小为
时,两细线内的张力均减小为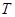 ,重力加速度为
,重力加速度为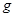 ,下列判断正确的有:( )
,下列判断正确的有:( )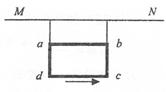
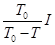 时,两细线内的张力均为零
时,两细线内的张力均为零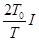 时,线圈的瞬时加速度大小为g,方向竖直向上
时,线圈的瞬时加速度大小为g,方向竖直向上