问题
填空题
(10分)
一种将CO2变为燃料或有机化学品的构想分成3个步骤:
①利用浓碳酸钾溶液吸收空气中的CO2;
②将第①步吸收液电解产生H2和O2,同时分离出CO2;
③将第②步产生的H2和CO2在一定条件下转化成CH4和H2O2。
已知:H2(g)+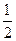 O2(g)=H2O(l) △H1=—285.8kJ/mol
O2(g)=H2O(l) △H1=—285.8kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H2=—889.6kJ/mol
H2O(l)=H2O(g) △H3=+44.0kJ/mol
(1)第③步反应的热化学方程式为 。
|
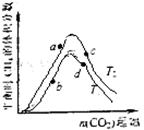
研究小组向恒温(T1、T2均大于100℃)恒容容器中充
入一定量的H2,在其他条件不变的情况下,改变起始
CO2的物质的量测定达到平衡时CH4的体积分数,实
验结果如右图所示。则a、c两点处所的平衡状态中,
氢气的转化率的大小关系是a(a) a(c)(填“>”“<”
或“=”),a、b、c、d四点所处的平衡状态中,对应的
平衡常数Ka、Kb、Kc、Kd的大小关系是 。
(4)H2和CO2在一定条件下也能转化成甲酸。甲酸,空气,质子交换膜和惰性电极组成的燃料电池工作时,负极发生的电极反应可表示为 。
答案
(10分,每空2分)
(1)CO2(g)+4H2(g)=CH4(g)+2H2O(l) △H=-253.6kJ/mol
或CO2(g)+4H2(g)=CH4(g)+2H2O(g) △H=-165.6kJ/mol
(2)5.6
(3)< Ka=Kt>Kb=Kd
(4)HCOOH-2e-=CO2↑+2H+