问题
选择题
已知CH4(g)+2O2(g) == CO2(g)+2H2O(l); ΔH=–Q1kJ·mol-1 ,
2H2(g)+O2(g)=2H2O(g);△H2=–Q2 kJ· ,
,
2H2(g)+O2(g) =2H2O(l);△H2=–Q3 kJ· 。
。
常温下,取体积比4∶1的甲烷和氢气的混合气体11.2L(标准状况下),经完全燃烧后恢复至室温,则放出的热量为
A. 0.4Q1+0.05Q3
B.0.4Q1+0.05Q2
C.0.4Q1+0.1Q3
D.0.4Q1+0.2Q2
答案
答案:A
混合气体为0.5mol,其中甲烷和氢气分别为0.4mol与0.1mol,而在题目所给条件下,水为液态,故放出的热量为0.4Q1+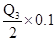 =0.4Q1+0.05Q3
=0.4Q1+0.05Q3
