问题
填空题
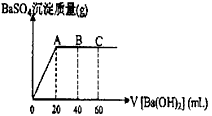
在t℃时,稀硫酸和盐酸混合液中,c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=12.向20mL该混合酸溶液中逐滴加入pH=11Ba(OH)2溶液,生成BaSO4的量如上图所示,当加入60mL Ba(OH)2溶液时,C点溶液的pH=6(体积变化忽略不计),
试计算:
(1)最初混合酸溶液中c(H2SO4)=___________ ,c(HCl)= ____________;
(2)A点pH=____________________ ;
(3)B点比最初混合酸的pH增加多少(写出计算过程)?(lg3=0.48) ____________________________________________________________________。
答案
(1)c(H2SO4)=0.05mol·L-1,c(HCl)=0.20mol·L-1
(2)pH=1
(3)最初混合酸c(H+)=0.05mol·L-1×2+0.20mol·L-1=0.30mol·L-1 pH=0.52 B点还没有完全中和,酸有剩余 c(H+)= =mol·L-1 pH=1.48,
所以B点比最初混合酸的pH增加1.48-0.52=0.96
