问题
计算题
在1.0mol·L-1Co2+溶液中,含有少量Fe3+杂质。问应如何控制pH,才能达到除去Fe3+杂质的目的。
Ksp{Co(OH)2}=1. 09×10-15,Ksp{Fe(OH)3}=2. 64×10-39
答案
①使Fe3+定最沉淀完全时的pH: Fe(OH)3(s)==Fe3++3OH-
Ksp{Fe(OH)3) =c(Fe3+). C3(OH-)
Fe3+沉淀的条件是c(Fe3+).c3(OH-)≥Ksp{Fe(OH)3}
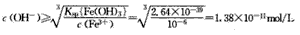
pH=14 -(-lgl. 38×10-11)=3.14
②使Co2+不生成Co(OH)2沉淀的pH:
Co(OH)2(s)=Co2++2OH-
Ksp{(Co(OH)2}=c(Co2+).c2(OH-)
不生成Co(OH)2沉淀的条件是
C(Co2+)c2(OH-)<Ksp{Co(OH)2)
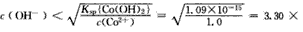 10-8mol/L
10-8mol/L
pH=14-(-lg3. 30×10-8)=6. 50
所以应将pH控制在3.14~6.5之问才能保证除去Fe3+,而Co2+ 留在溶液中。
