(14分) 甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:
(1)以天然气为原料制H2是合成氨的一条重要的路线。甲烷的部分氧化可得到合成氨的原料气H2,其反应式如下:
①CH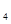 (g)+1/2O
(g)+1/2O (g)=CO(g)+2H
(g)=CO(g)+2H (g)
(g) 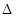 H1=-35.6kJ·mol
H1=-35.6kJ·mol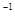
试判断常温下,上述反应能否自发进行: (填”能”或”否”)。有研究认为甲烷部分氧化的机理为:
②CH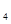 (g)+2O
(g)+2O (g)=CO2(g)+2H2O(g)
(g)=CO2(g)+2H2O(g)  H2=-890.3kJ·mol
H2=-890.3kJ·mol
③CH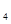 (g)+CO
(g)+CO (g)=2CO(g)+2H
(g)=2CO(g)+2H (g)
(g)  H3=247.3kJ·mol
H3=247.3kJ·mol
请结合以上条件写出CH4和H2O(g)生成CO和H2的热化学反应方程式:
。
⑵恒温下,向一个2L的密闭容器中充入1 molN2和2.6 molH2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
实验数据
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/( mol ·/L-1) | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
(3)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。
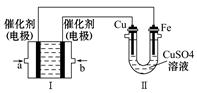
①b处电极上发生的电极反应式是 。
②电镀结束后,装置Ⅰ中溶液的pH (填写“变大”、“变小”或“不变”,下同),装置Ⅱ中Cu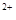 的物质的量浓度 。
的物质的量浓度 。
③若完全反应后,装置Ⅱ中阴极质量增加12.8g,则装置Ⅰ中理论上消耗甲烷 L (标准状况下)。
(14分)(1)能(1分)
CH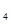 (g)+H2O(g)=CO(g)+3H2(g)
(g)+H2O(g)=CO(g)+3H2(g)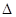 H=250.3kJ·mol
H=250.3kJ·mol (3分)其余每空2分
(3分)其余每空2分
(2)0.4 mol ·L-1
(3)① O2+2H2O+4e-=4OH- ②变小 不变 ③ 1.12
(1)该反应为一个熵增的放热反应,可以自发进行;通过盖斯定律,首先写出目标反应CH4(g)+H2O(g)=CO(g)+3H2(g),该反应等于(①×4-②-③),故ΔH=((-35.6)×4-(-890.3)-247.3)=250.3KJ/mol;
(2)
N2+3H2 2NH3 2NH3 | |||
| 始态mol/L | 0.5 | 1.3 | 0 |
| 反应mol/L | 0.1 | 0.3 | 0.20 |
| 终态mol/L | 0.4 | 1.0 | 0.20 |
(3)铁棒镀铜,可以确定Cu为阳极,Fe为阴极,整个电镀过程中电解质浓度没有变化;
左边为燃料电池,a为负极,甲烷失电子,b为正极,发生还原反应O2+2H2O+4e-=4OH-,整个过程中KOH的量不变,但有水生成,浓度减小,pH变小。根据得失电子守恒可以确定,消耗甲烷为1.12L
