(5分)氮是一种地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义。
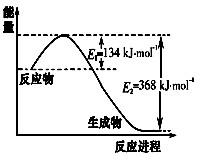
(1)下图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,写出NO2和CO反应的热化学方程式
(2) 自1913年工业合成氨投产以来,合成氨工业不断发展,氨又可以进一步制备硝酸,在工业上可进行连续生产。
请回答下列问题:
(1)已知:①N2(g)+O2(g)=2NO(g) △H1= +180.5kJ/mol
②N2(g)+3H2(g) 2NH3(g) △H2=-92.4kJ/mol
2NH3(g) △H2=-92.4kJ/mol
③2H2(g)+O2(g)=2H2O(g) △H3=-483.6kJ/mol
写出氨气经催化氧化生成一氧化氮气体和水蒸气的热化学方程式:
NO2(g)+CO(g)=CO2(g)+NO(g) △H=" —234" mol·L-1 (2分)
4NH3(g) +5 O2(g) ="4NO(g)" + 6H2O(g) △H=" —905.0" mol·L-1(3分)
(1)由图像可知,△H= —|E1—E2|=" —234" mol·L-1
(2)依据盖斯定律可知,①×2-②×2 + 3×3即可求得答案。

 H2SO3+2OH-
H2SO3+2OH-