(11分)在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。
(1)已知:N2(g)+ O2(g)="2NO(g)" △H="+180.5" kJ·mol-1
2C(s)+ O2(g)="2CO(g) " △H=-221.0 kJ·mol-1
C(s)+ O2(g)=CO2(g) △H=-393.5 kJ·mol-1
①尾气转化的反应之一:2NO(g)+2CO(g)=N2(g)+2CO2(g) △H= 。
②已知:N2、O2分子中化学键的键能分别是946 kJ·mol—1、497 kJ·mol—1,则NO分子中化学键的键能为 kJ·mol—1。
(2)某研究性学习小组在技术人员的指导下,在某温度时,按下列流程探究某种催化剂作用下的反应速率,用气体传感器测得不同时间的NO和CO浓度如表:
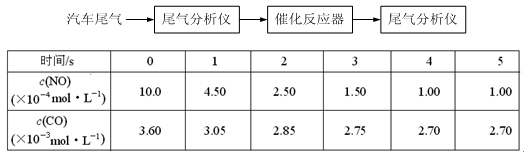
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
①前3s内的平均反应速率v (N2) = _________________________。
②在该温度下,反应的平衡常数K = 。(只写出计算结果)
③该可逆反应△S 0(填“>”、“<”或“=”),在_______________(填“高温”、“低温”或“任何温度”)下能自发进行。
(3)CO分析仪以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。下列说法错误的是
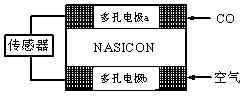
A.负极的电极反应式为:
CO+O2—―2e-=CO2
B.工作时电极b作正极,O2-由电极a流向电极b
C.工作时电子由电极a通过传感器流向电极b
D.传感器中通过的电流越大,尾气中CO的含量越高
(1)①-746.5 kJ·mol-1 (2分) ②631.25(2分)
(2)①1.42×10-4 mol/(L·s) (2分) ②5000(2分) ③<,低温(2分,各1分)
(3)B (1分)
(1)①按顺序将三个热化学方程式编号为①②③,根据盖斯定律③×2-①-②可得2NO(g)+2CO(g)=N2(g)+2CO2(g) △H=-746.5 kJ·mol-1。
②631.25
(2)①v (N2) =v (NO) = ×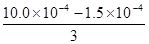 =1.42×10-4mol·L-1·s-1
=1.42×10-4mol·L-1·s-1
②反应至4s达平衡,此时
c(N2)=△c(NO)=×(10.0×10-4 mol·L-1-1.00×10-4 mol·L-1)=4.50×10-4 mol·L-1
c(CO2)=△c(NO)=10.0×10-4 mol·L-1-1.00×10-4 mol·L-1=9.00×10-4 mol·L-1
故化学平衡常数为:K=
==5000L·mol-1。
(3)该燃料电池的正极反应为:O2+4e-=2O2-,生成的O2-由b极向a极迁移,在a极参与负极反应:CO+O2—―2e-=CO2,故B项错误。
