(每空2分,共10分)依据事实,填空:
(1)已知某条件下可发生如下反应CH3-CH3→CH2=CH2+H2,有关化学键的键能如下:
| 化学键 | C-H | C=C | C-C | H-H |
| 键能(kJ/mol) | 414.4 | 615.3 | 347.4 | 435.3 |
(2)氢氧燃料电池已用于航天飞机。以30%KOH溶液为电解质的这种电池在使用时的电极反应式:正极: ;负极:
(3)某核素AZX的氯化物XCl2 1.11 g配成溶液后,需用1mol·L-1的硝酸银溶液20 ml才能把氯离子完全沉淀下来。则X的质量数为 ;
(4) 将甲烷和氧气的混合气体充入含有23.4 g Na2O2的密闭容器中,保持容器中温度为150 ℃,用电火花引燃充分反应后,压强为0 Pa,若将残留物溶于水,无气体逸出。此过程的总反应方程式为 。
(1)+125.6kJ·mol-1 (2)O2+2H2O+4e-==4OH- 2H2+4OH--4e-==4H2O
(3) 40 (4) 6Na2O2+2CH4+O2=2Na2CO3+8NaOH
(1)反应热就是断键吸收的能量和形成化学键所放出的能量的差值,即该反应的反应热是414.4 kJ/mol×6+347.4 kJ/mol-615.3 kJ/mol-414.4 kJ/mol×2-435.3 kJ/mol=+125.6 kJ/mol。
(2)在原电池中负极失去电子,发生氧化反应,正极得到电子,发生还原反应,所以氢氧燃料电池中氢气在负极通入,氧气在正极通入。又因为电解质是氢氧化钾,所以电极反应式分别是负极:2H2+4OH--4e-==4H2O、正极:O2+2H2O+4e-==4OH-。
(3)消耗硝酸银是1.0mol/L×0.02L=0.02mol,所以氯化物的物质的量是0.01mol,其相对分子质量是1.11÷0.01=111,所以X的质量数是111-35.5×2=40。
(4)根据题意可知,甲烷、氧气和过氧化钠恰好反应,因此最终的生成物是碳酸钠和氢氧化钠。设甲烷和氧气的物质的量是x和y,因为过氧化钠是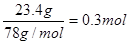 ,所以根据电子得失守恒可知8x=4y+0.3mol×2.根据氢原子守恒可知,氢氧化钠是4x,根据碳原子守恒可知碳酸钠是x。因此根据钠原子守恒可知4x+2x=0.3mol×2,解得x=0.1mol,所以y=0.05,即过氧化钠、甲烷和氧气的物质的量之比是6︰2︰1,所以方程式为6Na2O2+2CH4+O2=2Na2CO3+8NaOH。
,所以根据电子得失守恒可知8x=4y+0.3mol×2.根据氢原子守恒可知,氢氧化钠是4x,根据碳原子守恒可知碳酸钠是x。因此根据钠原子守恒可知4x+2x=0.3mol×2,解得x=0.1mol,所以y=0.05,即过氧化钠、甲烷和氧气的物质的量之比是6︰2︰1,所以方程式为6Na2O2+2CH4+O2=2Na2CO3+8NaOH。
