(10分)已知 2 mol SO2 (g) 氧化为2 mol SO3 (g) 的能量变化如图所示:
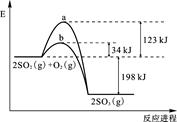
(1)写出SO2 (g) 氧化为SO3 (g) 的热化学方程式:
(2)氧化SO2时,工业上常加入V2O5作催化剂,其反应机理可表示为
SO2 + V2O5 = SO3 + 2VO2, 4VO2 + O2 = 2V2O5;
上图中表示加入V2O5的反应曲线为 (填“a”或“b”)。
(3)若在容积为2 L的密闭容器中充入2 mol SO2 (g)和1 mol O2 (g),如图甲所示,经2 min达到平衡,测得放出热量为178.2 kJ,则:

①2 min内 O2的化学反应速率v(O2)= ;
②若再充入1 mol O2重新达到平衡时,SO3平衡浓度的取值范围是: 。
(4)若将2 mol SO2 (g)和1 mol O2 (g)充入容积可变的容器乙中,初始体积为2 L,达到平衡时放出热量Q kJ,则Q 178.2 kJ(填“>”,“=”或“<”)。
(1)2SO2(g) + O2(g)  2SO3(g),ΔH=-198 kJ/mol (2)b
2SO3(g),ΔH=-198 kJ/mol (2)b
(3)① 0.225 mol·L-1·min-1 ② 0.9mol/L<c(SO3)<1 mol/L (4)>
(1)根据图像可知,反应是放热反应,所以热化学方程式为2SO2(g) + O2(g)  2SO3(g),ΔH=-198 kJ/mol。
2SO3(g),ΔH=-198 kJ/mol。
(2)催化剂能降低反应的活化能,但不能改变反应热,所以答案是b。
(3)①放出热量为178.2 kJ,则消耗的氧气是178.2÷198=0.9mol,所以氧气的反应速率是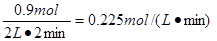 。
。
②在冲入氧气之前生成三氧化硫是1.8mol,但反应是可逆反应,所以无论冲入多少氧气,三氧化硫的物质的量不能超过2mol,所以浓度范围是0.9mol/L<c(SO3)<1 mol/L。
(4)乙是保持恒压的,又因为反应是体积减小的可逆反应,所以乙中反应物的转化率要大于甲中的,即放出的热量大于Q kJ。
