能源短缺是人类社会面临的重大问题,而“原子经济”就是反应物的原子全部转化为期望的最终产物。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I: CO(g) + 2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应II: CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
①上述反应符合“原子经济”原则的是 (填“I”或“Ⅱ”)。
②某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则H2的转化率为 。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH =-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH =-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH =-44.0 kJ/mol
请计算1 mol甲醇不完全燃烧生成1 mol一氧化碳和液态水放出的热量为
(1)① I (2分)②53.3% (各2分)(2) 442.8 kJ(3分
(1)①反应I中反应物全部进入生成物,所以符合“原子经济”原则的是I。
②c(CO)= 0.2 mol/L,则消耗CO的浓度是1mol/L-0.2mol/L=0.8mol/L.消耗氢气是1.6mol/L,所以氢气转化率是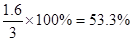
(2)①-②+③×4即得到2CH3OH(l) +2O2(g) = 2CO(g) + 4H2O(l),所以该反应的反应热是1275.6 kJ/mol+566 kJ/mol-44 kJ/mol×4=-885.6 kJ/mol。1 mol甲醇不完全燃烧生成1 mol一氧化碳和液态水放出的热量为442.8 kJ。
