问题
选择题
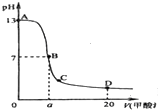
在15mLKOH溶液中逐滴加入0.2mol•L-1甲酸溶液,溶液ph和加入的甲酸的体积关系曲线如图所示,有关离子浓度大小关系正确的是( )
A.该KOH溶液的浓度为0.1mol•L-1
B.在B点:c(K+)=c(HCOO)>c(OH)=c(H+),且a=7.5
C.在C点:c(HCOO)>c(K+)>c(OH)>c(H+)
D.在A、B间任意一点,c(K+)>c(HCOO)>c(OH)>c(H+)
答案
A.未滴定甲酸时,溶液的pH=13,KOH是强电解质完全电离,则c(KOH)=c(OH-)=0.1mol/L,故A正确;
B.B点,溶液呈中性,则c(OH-)=c(H+),甲酸钾是强碱弱酸盐,要使溶液呈中性,酸的物质的量应该稍微大于碱,所以a>7.5,故B错误;
C.C点,pH<7,溶液呈酸性,则c(H+)>c(OH-),根据电荷守恒得c(HCOO-)+c(OH-)=c(H+)+c(K+),所以得c(HCOO-)>c(K+),故C错误;
D.在A、B间任意一点,因为开始时c(OH-)>c(HCOO-),即也有可能是c(K+)>c(OH-)>c(HCOO-)>c(H+),故D错误;
故选A.
