已知水在25℃和95℃时,其电离平衡曲线如图所示:
(1)则25℃时水的电离平衡曲线应为______;(填“A”或“B”),请说明理由______;
(2)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为______;曲线B对应温度下,250mL 0.lmol/L的HCl溶液和250mL0.3mol/L的NaOH溶液混合,求混合后溶液的pH=______;
(3)25℃时,将PH=13的NaOH溶液l0mol逐滴滴入PH=1的CH3COOH溶液10ml中,反应后溶液的pH______ 7(填“>”、“<”或“=”).
(4)-50℃时,液氨存在如下电离:2NH3⇌NH4++NH2-,K=2×10-12,往液氨中加入NH4C1固体,K______2×10-12(填“<”、“>”或“=”)
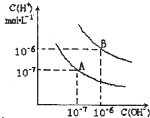
(1)水的电离是吸热过程,升高温度,使水的电离程度增大,当温度升高时,促进水的电离,水的离子积增大,水中氢离子、氢氧根离子浓度都增大,水的pH减小,但溶液仍然呈中性;
故答案为:A;水的电离是吸热过程,温度低时,电离程度小,c(H+)、c(OH-)小;
(2)95°C时纯水的pH=6,混合溶液的pH=7,说明酸、碱混合时碱过量溶液呈碱性,混合溶液中c(OH-)=10-6×10-6 10-7
mol/L=10-5 mol/L,pH=9的NaOH溶液中c(OH-)=
mol/L=10-3mol/L,设酸的体积为x,碱的体积为y,c(OH-)=10-6×10-6 10-9
=10-5 mol/L,y:x=1:9;10-3y-10-4x x+y
混合溶液中c(OH-)=
=0.1mol/L,c(H+)=(0.3-0.1)mol/L×0.25L 0.25L×2
mol/L=10-11 mol/L,则溶液的pH=11,10-6×10-6 0.1
答:NaOH溶液与H2SO4溶液的体积比是1:9,11;
(3)将PH=13的NaOH溶液物质的量浓度是0.1mol/L,PH=1的CH3COOH溶液中醋酸的物质的量浓度大于0.1mol/L,25℃时,将PH=13的NaOH溶液l0mol逐滴滴入PH=1的CH3COOH溶液10ml中,酸剩余,则溶液呈酸性,溶液的pH<7,
故答案为:<;
(4)往液氨中加入氯化铵,氯化铵中含有铵根离子能抑制液氨电离,弱电解质的电离平衡常数与温度有关,温度不变,则液氨的电离平衡常数不变,故答案为:=.
