下列方程式的书写或描述正确的是
A.等质量的硫蒸气和硫固体分别在氧气中完全燃烧,后者放出的热量多
B.热化学方程式C2H2(g)+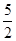 O2(g)
O2(g)2CO2(g)+H2O(g);△H="-1256" kJ·mol-1,可知乙炔的燃烧热为1256 kJ·mol-1
C.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式为: 2H2(g)+O2(g)=2H2O(l)ΔH= -285.8kJ·mol-1
D.稀溶液中:H+(aq)+OH—(aq)=H2O(l)ΔH=" —53.7kJ/mol" ,若将含0.5 molH2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量大于53.7kJ
答案:D
物质在气态时的能量高于在固态时的能量,所以等质量的硫蒸气和硫固体分别在氧气中完全燃烧,前者放出的热量多,A不正确。燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,水的稳定状态是液态,B不正确。C这反应热的数值不正确,应该是571.6kJ/mol ,不正确。硫酸的浓溶液溶于水会放热,所以选项D是正确的,答案选D。
