(12分)⑴已知甲醇在常温下为液体,其热值为22.7kJ•g-1,则甲醇的标准燃烧热的热化学方程式为_______________________________________________。
⑵将甲醇、氧气和氢氧化钾溶液设计成燃料电池,该电池正极反应式为
____________________________________。
⑶右图为工业上氯碱工业的电解槽示意图,据图回答:
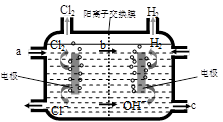
①图中a、b、c处物质名称分别是: a_________________;b________________;c___________________。
②若没有阳离子交换膜,则电解一段时间后在电解槽的溶液中可能发生的化学反应方程式为__________________________。
⑷反应2A B+C 在某一温度时达到平衡。
B+C 在某一温度时达到平衡。
①若温度升高,平衡向正反应方向移动,则正反应是__________热反应;
②若B为固体,降低压强平衡向逆反应方向移动,则A呈____________态;
③若A是气态时,加压时,平衡不移动,则B为_________态,C为________态。
⑴CH3OH(l)+3 2O2(g)=CO2(g)+2H2O(l) ΔH=726.4kJ•mol-1(2分)
⑵O2+4e-+2H2O=4OH-(1分)
⑶①饱和食盐水、钠离子、氢氧化钠溶液(各1分)
②Cl2+2NaOH ="NaClO" +NaCl+H2O(2分) ⑷①吸②气③气、气(各1分)
(1)燃烧热是指在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,所以根据热值为22.7kJ•g-1可知燃烧热是22.7kJ•g-1×32g/mol=726.4kJ•mol-1,即热化学方程式为CH3OH(l)+3 2O2(g)=CO2(g)+2H2O(l) ΔH=726.4kJ•mol-1。
(2)原电池中正极得到电子,所以氧气在正极通入,反应式为O2+4e-+2H2O=4OH-。
(3)①根据装置可知a出加入的是饱和食盐水。阳离子交换膜只允许阳离子通过每一次b是钠离子。阴极产生氢氧化钠,所以c处是氢氧化钠。
②若没有阳离子交换膜,则反应中产生的氯气能和氢氧化钠反应,方程式为Cl2+2NaOH ="NaClO" +NaCl+H2O。
(4)①温度升高,平衡向正反应方向移动,则正反应是吸热反应。
②降低压强平衡向逆反应方向移动,说明正反应是体积减小的。由于B是固体,所以A是气体。
③若A是气态时,加压时,平衡不移动,说明反应前后体积不变,所以BC都是气体。
