(提前进度)
(1)已知H2O(1)=H2O(g);△H=+44KJ/mol。在25℃、101 kPa下,1g甲醇燃烧生成CO2和气态水时放热19.93kJ,则该反应的热化学方程式应为______。
(2)已知H2的燃烧热△H=-285.8kJ·mol-1,CO的燃烧热△H=-282.8 kJ·mol-1。现有CO、H2、CO2组成的混合气体67.2L(标准状况),经充分燃烧后放出的总热量为710.0 kJ,并生成18g液态水,求燃烧前混合气体中CO的体积分数。
(1)CH3OH(l)+3/2O2(g)=(g)CO2(g)+2H2O(l) △H=-725.76kJ/mol (3分)
(2)50%
(1)1g甲醇燃烧生成CO2和气态水时放热19.93kJ,则1mol甲醇燃烧燃烧非常的热量是19.93kJ×32=637.76kJ。生成的2mol气态水变成液态水,又放出44kJ×2=88kJ,所以总共放出的热量是637.76kJ+88kJ=725.76kJ,所以热化学方程式为
CH3OH(l)+3/2O2(g)=(g)CO2(g)+2H2O(l) △H=-725.76kJ/mol 。
(2)考查根据方程式进行的有关计算。
(2)标准状况下n(混合气体)=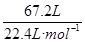 ="3" mol(1分)
="3" mol(1分)
其中有n(H2)= 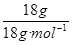 ="1" mol (2分)
="1" mol (2分)
1mol H2燃烧生成液态水时放热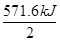 =285.8kJ(1分)
=285.8kJ(1分)
CO燃烧时放出的热量为710.0kJ-285.8kJ=424.2kJ(CO2不燃烧)(1分)
故n(CO)=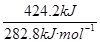 =1.5mol(1分)
=1.5mol(1分)
CO的体积分数为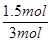 ×100%=50% (1分)
×100%=50% (1分)
