问题
计算题
主族元素R的最高价氧化物0. 112 g,溶于水制得100 g碱性溶液,其溶质的质量分数为0.148%,R原子核内含有20个中子。试通过计算,确定R元素在周期表中的位置。
答案
设R的相对原子质量为A,化合价为+x。
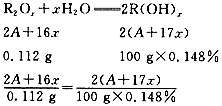
A=20x
(1)当x=l时,A=20,则原子核内不含质子,这种元素不可能存在。
(2)当x=2时,A=40,40-20=20,20号元素为Ca。
(3)当x=3时,A=60,则质子数为40。在已知元素中,除11H外,其余元素的原子核内中子数与质子数的比都等于或大于1,而且随原子核电荷数的增大,这个比值增大。所以质子数大于中子数是不可能的,因此x≥3的元素都不可能存在。
综上所述,元素R为钙(Ca)。在元素周期表中位于第四周期ⅡA族。
