(8分)碳是化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质。
(1)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1molCl2参与反应时释放出145kJ热量,写出该反应的热化学方程式: 。
(2)科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇。已知H2(g)、CO(g)和CH3OH(l)的燃烧热ΔH分别为-285.8kJ·mol-1、-283.0kJ·mol-1和-726.5kJ·mol-1。则:
①用太阳能分解10mol水消耗的能量是_____________kJ;
②甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_______ ____ 。
(3)已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) △H=+489.0 kJ·mol-1
CO(g)+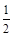 O2(g) =CO2(g),△H=-283.0 kJ·mol-1
O2(g) =CO2(g),△H=-283.0 kJ·mol-1
C(石墨)+O2(g) =CO2(g),△H=-393.5 kJ·mol-1
则4Fe(s)+3O2(g) =2Fe2O3(s),△H= 。
(8分)(1)2Cl2(g)+2H2O(g)+C(s)=4HCl(g)+CO2(g) ΔH=-290kJ·mol-1
(2)①2858 ②CH3OH(l)+O2(g)=CO(g)+2H2O(l) ΔH=-443.5kJ·mol-1
(3)-1641.0 kJ·mol-1
(1)反应的化学方程式为:2Cl2(g)+2H2O(g)+C(s)=4HCl(g)+CO2(g),当2mol Cl2参加反应时放出的热量为:145kJ×2=290kJ,故该反应的热化学方程式为:2Cl2(g)+2H2O(g)+C(s)=4HCl(g)+CO2(g) ΔH=-290kJ·mol-1。
(2)①分解10mol水消耗的能量在数值上等于10mol H2(g)完全燃烧时所放出的热量:10mol×285.8kJ·mol-1=2858kJ;②根据CO(g)、CH3OH(l)燃烧热的热化学方程式,再由盖斯定律可写出甲醇不完全燃烧的热化学方程式。
(3)运用盖斯定律,将第三个反应×6-第一个反应×2-第二个反应×6,可得目标反应,则△H=-393.5 kJ·mol-1×6-489.0 kJ·mol-1×2-(-283.0 kJ·mol-1) ×6=-1641.0 kJ·mol-1。
