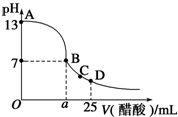
在25mL氢氧化钠溶液中逐滴加入0.2mol•L-1醋酸溶液,滴定曲线如图所示.
(1)写出氢氧化钠溶液与醋酸溶液反应的离子方程式:______.
(2)该氢氧化钠溶液的物质的量浓度为______mol•L-1.
(3)在B点,a______12.5mL(填“>”、“<”或“=”,下同).若由体积相等的氢氧化钠和醋酸溶液混合而且恰好呈中性,则混合前c(NaOH)______c(CH3COOH),混合前酸中c(H+)和碱中c(OH-)的关系:c(H+)______c(OH-).
(4)在D点,溶液中离子浓度大小关系为:______.
(1)反应生成醋酸钠和水,醋酸和水在离子反应中保留化学式,该离子反应为OH-+CH3COOH═CH3COO-+H2O,故答案为:OH-+CH3COOH═CH3COO-+H2O;
(2)由开始NaOH溶液的pH=13,c(OH-)=c(NaOH)=0.1mol/L,故答案为:0.1;
(3)B点pH=7,a=12.5mL时恰好生成醋酸钠,溶液显碱性,则醋酸应过量使pH=7,即a>12.5mL;由体积相等的氢氧化钠和醋酸溶液混合而且恰好呈中性,浓度相同时溶液显碱性,则酸的浓度大,即c(NaOH)<c(CH3COOH),又混合前碱完全电离,而酸不能完全电离,则混合前酸中c(H+)和碱中c(OH-)的关系为c(H+)<c(OH-),故答案为:>;<;<;
(4)D点,溶液显酸性,为醋酸钠和醋酸的混合溶液,醋酸电离为主,则离子浓度大小关系为c(CH3COO-)>c(Na+)>c(H+)>c(OH-),
故答案为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-).
