下列叙述中,正确的是( )
A.甲烷的标准燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:
CH4(g) + 2O2(g) ="==" CO2(g) + 2H2O(g) ΔH=-890.3 kJ·mol-1
B.500 ℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应,放热19.3 kJ,其热化学方程式为: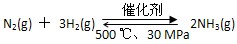 ΔH=-38.6 kJ·mol-1
ΔH=-38.6 kJ·mol-1
C.相同条件下,2mol氢原子所具有的能量小于1mol氢分子所具有的能量
D.常温下,反应C(s) + CO2(g) ="==" 2CO(g)不能自发进行,则该反应的ΔH>0
答案:D
燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,水的稳定状态是液态,选项A不正确;氢气和氮气生成氨气的反应是可逆反应,转化量不能确定,所以选项B中不能计算反应热大小,不正确;氢原子生成氢气的反应是放热反应,即氢气的总能量小于氢原子的总能量,所以选项C不正确;选项D中反应是熵值增加的,反应不能自发,说明反应一定是吸热反应,选项D正确,答案选D。
