(6分)利用盖斯定律解答下列各小题
(1)已知反应:H2(g)+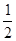 O2(g)==H2O(g) △H1 N2(g)+2O2==2NO2(g) △H2
O2(g)==H2O(g) △H1 N2(g)+2O2==2NO2(g) △H2
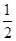 N2(g)+
N2(g)+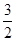 H2(g)==NH3(g) △H3
H2(g)==NH3(g) △H3
利用上述三个反应,计算4NH3(g)+7O2(g)==4NO2(g)+6H2O(g)的反应焓变为 (用含△H1、△H2、△H3的式子表示)。
(2) 已知:CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH=+206.2 kJ·mol-1
CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH=+247.4 kJ·mol-1
则以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为: 。
(1) 6△H1 + 2△H2- 4△H3 (2) CH4(g)+2H2O(g)===CO2(g)+4H2(g) ΔH=+165.0 kJ·mol-1。
(1)考查反应热的有关计算。根据盖斯定律可知,①×6+②×2-③×4即得到4NH3(g)+7O2(g)==4NO2(g)+6H2O(g),所以该反应的反应热是△H=6△H1 + 2△H2- 4△H3 。
(2)根据盖斯定律可知,①×2-②即得到CH4(g)+2H2O(g)===CO2(g)+4H2(g),所以该反应的反应热是△H=+206.2 kJ·mol-1×2-247.4 kJ·mol-1=165.0 kJ·mol-1。
