每空2分,共12分)化学反应可为人类提供能量
(Ⅰ)家用液化气的主要成分之一是丁烷(C4H10),常温常压下,当5.8 kg丁烷完全燃烧并生成二氧化碳和液态水时,放出热量为2.9×105kJ,试写出丁烷燃烧的热化学方程式:____________________________________________,已知1mol液态水气化时需要吸收44 kJ的热量,则反应:
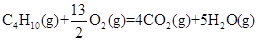 的ΔH为____________________。
的ΔH为____________________。
(Ⅱ)铅蓄电池是化学电源,其电极材料分别是Pb和PbO2,电解质溶液为稀硫酸。工作时,该电池的总反应为PbO2+Pb+2H2SO4=2PbSO4+2H2O,根据上述情况判断:
(1)蓄电池的负极是______,其电极反应式为______________________________。
(2)蓄电池的正极电极反应式为_________________________________。
(3)蓄电池工作时,其中电解质溶液的pH______(填“增大”、“减小”或“不变”)。
(每空2分,共12分)
(Ⅰ)2 C4H10(g)+13O2(g)=8CO2(g)+10H2O(l) △H=-5800kJ·mol-1 -2680kJ·mol-1
(Ⅱ)(1)Pb Pb-2e+-SO42-=PbSO4。
(2)PbO2+4H++SO42-+2e-=PbSO4+2H2O。 (3)增大
(Ⅰ)5.8 kg丁烷完全燃烧并生成二氧化碳和液态水时,放出热量为2.9×105kJ,所以1mol丁烷完全燃烧放出的热量是2.9×105kJ÷100=2.9×103kJ,所以反应的热化学方程式是2C4H10(g)+13O2(g)=8CO2(g)+10H2O(l) △H=-5800kJ·mol-1;1mol液态水气化时需要吸收44 kJ的热量,所以5mol液态水气化时需要吸收220 kJ的热量,因此C4H10(g)+13/2O2(g)=4CO2(g)+5H2O(l) △H=-(2900-220)kJ/mol=-2680kJ/mol。
(Ⅱ)(1)原电池中负极失去电子,所以根据总反应式可知,蓄电池的负极是Pb,电极反应式是Pb-2e+-SO42-=PbSO4。
(2)正极是得到电子的,所以二氧化铅在正极得到电子,电极反应式是PbO2+4H++SO42-+2e-=PbSO4+2H2O。
(3)根据总反应式可知,蓄电池工作时,消耗稀硫酸,所以溶液的pH增大。
