(5分)把煤作为燃料可通过下列两种途径:
途径Ⅰ C(s)+O2(g)=====CO2(g);ΔH1<0 ①
途径Ⅱ 先制成水煤气:
C(s)+H2O(g)=====CO(g)+H2(g);ΔH2>0 ②
再燃烧水煤气:
2CO(g)+O2(g)=====2CO2(g);ΔH3<0 ③
2H2(g)+O2(g)=====2H2O(g);ΔH4<0 ④
请回答下列问题:
(1)途径Ⅰ放出的热量理论上_________(填“大于”“等于”或“小于”)途径Ⅱ放出的热量。
(2)ΔH1、ΔH2、ΔH3、ΔH4的数学关系式是_______________。
(3).已知:① C(s)+O2(g)=CO2(g); DH=—393.5 kJ·mol-1
② 2CO(g)+O2(g)=2CO2(g); DH=-566 kJ·mol-1
③ TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g); DH=+141 kJ·mol-1
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的DH= 。
(5分)(1)等于(1分) (2 ) ΔH1 = ΔH2 +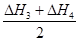 (3) -80 kJ·mol-1
(3) -80 kJ·mol-1
(1)根据能量守恒定律可知,两条途径中放出的能量是相等的。
(2)根据盖斯定律可知,②+(③+④)÷2即得到反应①,所以ΔH1 = ΔH2 +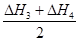 。
。
(3)根据盖斯定律可知,③+①×2-②即得到TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g),所以DH=-393.5kJ/mol×2+141kJ/mol+566kJ/mol=-80kJ/mol.

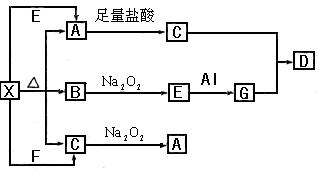
 A的离子方程式:_____________________________________
A的离子方程式:_____________________________________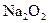 参加反应的化学方程式______________________________________,
参加反应的化学方程式______________________________________,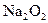 转移的电子数为_____________个。
转移的电子数为_____________个。