问题
选择题
已知下列热化学方程式
(l)C(s)+1/2O2(g)=CO(g) △H1=-110.5kJ/mol
(2)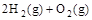 =2H2O(g) △H2=-483.6 kJ·
=2H2O(g) △H2=-483.6 kJ·
由此可知 C(s)+ H2O(g) == CO(g) + H2(g) △H3。则 ΔH3等于( )
A.+131.3kJ·mol—1
B.-131.3kJ·mol—1
C.+373.1kJ·mol—1
D.-373.1kJ·mol—1
答案
答案:A
考查反应热的金属。更具有盖斯定律可知,(1)-(2)÷2即得到C(s)+ H2O(g) == CO(g) + H2(g) ,所以△H3=-110.5kJ/mol+483.6kJ/mol÷2=+131.3kJ/mol,答案选A。
