CO2的固定和利用在降低温室气体排放中具有重要作用,从CO2加氢合成甲醇不仅可以有效缓解减排压力,还是其综合利用的一条新途径。CO2和H2在催化剂作用下能发生反应CO2+3H2 CH3OH+H2O,测得甲醇的理论产率与反应温度、压强的关系如图所示。请回答下列问题:
CH3OH+H2O,测得甲醇的理论产率与反应温度、压强的关系如图所示。请回答下列问题:
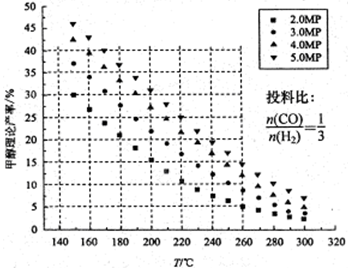
(1)提高甲醇产率的措施是 。
(2)分析图中数据可知,在220 ℃、5MPa时,CO2的转化率为 ,再将温度降低至
140℃,压强减小至2MPa,化学反应速率将 (填“增大、减小 或 不变“ 下同),CO2的转化率将 。
(3)200℃时,将0.100molCO2和0.275molH2充入1L密闭容器中,在催化剂作用下反应达到平衡。若CO2的转化率为25%,则此温度下该反应的平衡常数K= 。(要求写出算式和计算结果)
(4)已知已知:CO的燃烧热△H=-283.0KJ/mol、2H2(g)+O2(g)=2H2O(g) △H=-483.6KJ/mol、
CO(g)+2H2(g)=CH3OH(g) △H=-90.1KJ/mol,写出CO2与H2合成甲醇的热化学方程式 。
(1)降温、加压(2分) (2)25%(2分) 减小(2分) 增大(2分)
(3)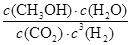 =
=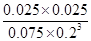 =1.04 (3分)
=1.04 (3分)
(4)CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ∆H=-48.9 kJ/mol(3分)
题目分析:(1)根据图像可知,随着温度的升高,甲醇的产率降低,这说明正方应是放热反应。再温度相同时,增大压强,甲醇的产率增大,所以提高甲醇产率的措施是降温、加压。
(2)分析图中数据可知,在220 ℃、5MPa时,甲醇的产率是25%。根据碳原子守恒,1molCO2生成1mol甲醇,因此甲醇的产率就是CO2的转化率,所以CO2的转化率为25%。降温并同时降低压强,反应速率减小。由于正方应是放热的体积减小的可逆反应,因此降温和降低压强平衡均向正反应方向移动,所以CO2的转化率增大。
(3) CO2(g)+3H2(g)===CH3OH(g)+H2O(g)
起始浓度(mol/L)0.100 0.275 0 0
转化浓度(mol/L)0.0250 0.0750 0.0250 0.0250
平衡浓度(mol/L)0.0750 0.200 0.0250 0.0250
所以该温度下反应的平衡常数K=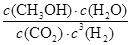 =
=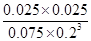 =1.04
=1.04
(4)CO的燃烧热△H=-283.0KJ/mol,则有热化学方程式①2CO(g)+O2(g)=2CO2(g) △H=-566.0KJ/mol。又因为反应②2H2(g)+O2(g)=2H2O(g) △H=-483.6KJ/mol、③CO(g)+2H2(g)=CH3OH(g) △H=-90.1KJ/mol,所以根据盖斯定律可知,(③×2-①+②)÷2,及得到反应CO2(g)+3H2(g)===CH3OH(g)+H2O(g),所以该反应的反应热∆H=(-90.1KJ/mol×2+566.0KJ/mol-483.6KJ/mol)÷2=-48.9 kJ/mol。

 ,若不考虑原入射光在bc面上的反射光,则有光线
,若不考虑原入射光在bc面上的反射光,则有光线