氮可以形成多种化合物,如NH3、N2H4、HCN、NH4NO3等。
(1)已知:N2(g)+2H2(g)=N2H4(l) △H=" +" 50.6kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H="-571.6" kJ·mol-1
则①N2H4(l)+O2(g)=N2(g)+2H2O(l) △H= kJ·mol-1
②N2(g)+2H2(g)=N2H4(l) 不能自发进行的原因是 。
③用次氯酸钠氧化氨,可以得到N2H4的稀溶液,该反应的化学方程式是 。
(2)采矿废液中的CN-可用H2O2处理。已知:H2SO4=H++ HSO4- HSO4-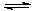 H++ SO42-
H++ SO42-
用铂电极电解硫酸氢钾溶液,在阳极上生成S2O82-,S2O82-水解可以得到H2O2。写出阳极上的电极反应式 。
(3)氧化镁处理含 的废水会发生如下反应:
的废水会发生如下反应:
MgO+H2O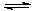 Mg(OH)2 Mg(OH)2+2NH4+
Mg(OH)2 Mg(OH)2+2NH4+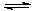 Mg2+ +2NH3·H2O。
Mg2+ +2NH3·H2O。
①温度对氮处理率的影响如图所示。在25℃前,升高温度氮去除率增大的原因是 。
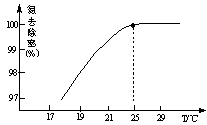
②剩余的氧化镁,不会对废水形成二次污染,理由是 。
(4)滴定法测废水中的氨氮含量(氨氮以游离氨或铵盐形式存在于水中)步骤如下:①取10 mL废水水样于蒸馏烧瓶中,再加蒸馏水至总体积为175 mL②先将水样调至中性,再加入氧化镁使水样呈微碱性,加热③用25 mL硼酸吸收蒸馏出的氨[2NH3+4H3BO3=(NH4)2B4O7+5H2O]④将吸收液移至锥形瓶中,加入2滴指示剂,用c mol·L-1的硫酸滴定至终点[(NH4)2B4O7+H2SO4+5H2O=(NH4)2SO4+4H3BO3],记录消耗的体积V mL。则水样中氮的含量是 mg·L-1(用含c、V的表达式表示)。
(1)①-622.2 ②△H>0 △S<0 ③NaClO+2NH3=N2H4+NaCl+H2O
(2)2HSO4--2e-= S2O82-+2H+
(3)① 升高温度NH3的溶解度降低,有利于NH3的逸出
② 氧化镁难溶于水中,以沉淀的形式排出,因此不会形成二次污染
(4)2800cV
题目分析:(1)①热化学方程式②-①即可得到对应热化学方程式;②该反应的△H>0 △S<0(气体体积减少),故不能自发进行;(2)题意给出HSO4-是弱离子,所以要写成整体式子,电解池的阳极失去电子,2HSO4--2e-= S2O82-+2H+ ;(3) 升高温度气体的溶解度降低,能使其从溶液中逸出,使反应的平衡体系正向移动,氮去除率增大;氧化镁难溶于水中,以沉淀的形式排出,因此不会形成二次污染。
