(10分)(1)肼(N2H4)又称联氨,是一种可燃性液体,可用作火箭燃料。已知在101kPa,320g N2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧的热化学方程式是:
(2)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20~30%的KOH溶液。肼—空气燃料电池放电时,正极的电极反应式是 ;负极的电极反应式是 。
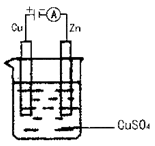
(3)如图是一个电化学过程示意图。假设使用肼—空气燃料电池作为本过程的电源,铜片质量变化128g,则肼—空气燃料电池理论上消耗标准状况下的空气 L(假设空气中氧气的体积含量为20%)。
(4)传统制备肼的方法是以NaClO氧化NH3制得肼的稀溶液,该反应的离子方程式是 。
(1)N2H4(l)+O2(g)=N2(g)+2H2O(l);△H=-62.4KJ·mol-1
(2)正:O2+2H2O+4e—=4OH— 负:N2H4+4OH—-4e—=N2+4H2O
(3)112 L (4)ClO—+2NH3=Cl—+N2H4+H2O
题目分析:(1)320g肼恰好是10mol,所以热化学方程式为N2H4(l)+O2(g)=N2(g)+2H2O(l);△H=-62.4kJ/mol。
(2)原电池中正极得电子发生还原反应,所以空气是正极,在碱性电解质溶液中电极反应为:O2+2H2O+4e—=4OH—;负极失电子发生氧化反应,所以肼是负极,在碱性电解质溶液中电极反应为: N2H4+4OH--4e-=4H2O+N2↑。
(3)根据装置可知,铜和电源的正极相连,作阳极。因此反应中转移电子是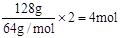 所以根据电子得失守恒可知,消耗氧气是1mol,则空气是5mol,标准状况下的体积是5mol×22.4L/mol=112L。
所以根据电子得失守恒可知,消耗氧气是1mol,则空气是5mol,标准状况下的体积是5mol×22.4L/mol=112L。
(4)NaClO氧化NH3的离子方程式是ClO—+2NH3=Cl—+N2H4+H2O。
点评:本题综合性比较强,知识点比较基础,难度小。
